细胞自噬是一种溶酶体介导的降解途径,可以选择性清除胞内不需要的蛋白聚集体和受损的细胞器,以维持细胞稳态平衡。近年来的研究表明,通过液-液相分离(liquid-liquid phase separation, LLPS)形成的蛋白凝聚体在应激或者病理条件下发生异常的相转变,从而逃逸自噬降解。
张宏实验室前期的研究发现,在正常培养条件下(15-25 oC),线虫胚胎体细胞中,母系来源的P颗粒组分PGL-1和PGL-3在受体蛋白SEPA-1和支架蛋白EPG-2的参与下,形成凝聚体被自噬选择性清除。而在热应激条件下(26 oC),PGL-1和PGL-3逃逸自噬降解,在胚胎体细胞中累积成蛋白聚集体,称为PGL颗粒,以应对热应激。目前这些机体应对应激条件形成的聚集体,以及与多种疾病发生发展密切相关的异常累积的蛋白聚集体逃逸自噬降解的分子机制知之甚少。
2023年4月4日,中国科学院生物物理研究所张宏课题组在Journal of Cell Biology杂志在线发表了题为"RNA recruitment switches the fate of protein condensates from autophagic degradation to accumulation"的研究论文。该文发现:热应激条件下,线虫胚胎中形成富含mRNA的PGL颗粒。mRNA促进PGL蛋白的液-液相分离、维持形成的凝聚体的液态性质,并抑制支架蛋白EPG-2的招募,从而促使PGL颗粒逃逸自噬降解,帮助胚胎应对热应激。
研究者发现在热应激条件下,线虫胚胎体细胞中形成一种不同于应激颗粒(stress granules)和加工小体(P bodies)的新型RNP(核糖核蛋白,ribonucleoprotein)颗粒,称为PGL颗粒。除了PGL蛋白外,PGL颗粒还包含mRNA及参与RNA翻译和代谢的因子,例如翻译起始因子IFE-1。进一步研究发现,热应激条件下累积的PGL颗粒在组成成分、动态变化和时空分布等方面都与应激颗粒和加工小体不同。
随后研究发现,mRNA参与调控PGL颗粒的自噬降解。前期研究表明支架蛋白EPG-2通过促进PGL颗粒从液态到凝胶状的转变,从而促进PGL颗粒的自噬降解。我们发现,热应激条件下,mRNA通过促进PGL蛋白发生液-液相分离,抑制支架蛋白EPG-2的招募,维持PGL颗粒的液态性质,从而调控PGL颗粒的自噬降解。
综上,该研究发现在热应激条件下,PGL颗粒招募mRNA以及参与RNA相关过程的蛋白,形成RNP颗粒逃避自噬清除,以增强胚胎对热应激的耐受。在多种神经退行性疾病相关的蛋白聚集体中也检测到大量RNA的累积。我们的研究为阐明应激或者病理条件下蛋白聚集体逃逸自噬降解的机制提供新的视角和线索。
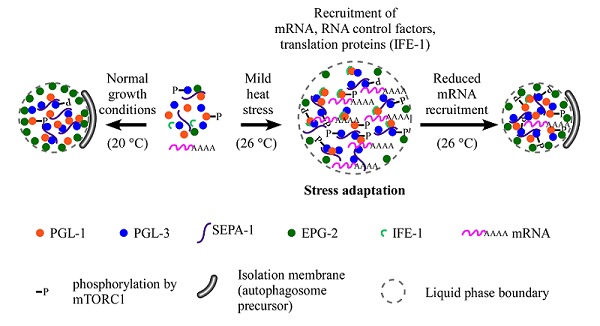
图. RNA在正常和热应激条件下调控PGL颗粒命运转变的模式图
该研究获得国家自然科学基金、国家重点研发计划资助。生物物理所质谱平台为该研究提供了重要的技术支持。
文章链接:https://doi.org/10.1083/jcb.202210104
(供稿:张宏研究组)
 附件下载:
附件下载: