干细胞移植是再生医学中极具潜力的方法之一,为攻克许多重大难治性疾病提供了希望。"干细胞研究与器官修复"已列入"十四五国家重点研发计划",国内干细胞领域的标准也在不断发展和完善。其中,胚胎干细胞(ESCs)和诱导性多功能干细胞(iPSCs)分化潜能强大,但因具有极强的致瘤性和免疫排斥限制了它们在临床的直接应用。相比之下,间充质干细胞(MSCs)不存在上述问题,并且得到了广泛应用。但是,MSCs移植存在促炎性等风险,其安全性在临床上仍然面临挑战。
干细胞来源的外泌体是一种由干细胞分泌的细胞外囊泡,其含有许多生物活性物质,如蛋白质、脂质和核酸,是细胞间信号传递的载体,能够替代干细胞发挥器官及组织损伤修复等生物学过程。特别是外泌体规避了干细胞移植中存在的潜在风险,且具有极低的免疫原性、便于保存和运输等优点,已经得到了广泛关注。
目前,人间充质干细胞来源的外泌体(MSC-Exos)组分已经得到了阐明,但是人源胚胎干细胞外泌体(hESC-Exos)和人诱导性多功能干细胞外泌体(hiPSC-Exos)的生物学特性还未被研究。2022年9月5日中国科学院生物物理研究所姬广聚课题组在《Stem cell research & therapy》杂志上在线发表了题为"Systemic proteomics and miRNA profile analysis of exosomes derived from human pluripotent stem cells"的研究论文,系统揭示了hESC-Exo和hiPSC-Exos的蛋白组份和miRNA组份构成,并和人脐带间充质干细胞来源的外泌体(hUC-MSC-Exos)组份进行了详细的比对分析,为3种干细胞外泌体临床前和临床实验提供重要参考。
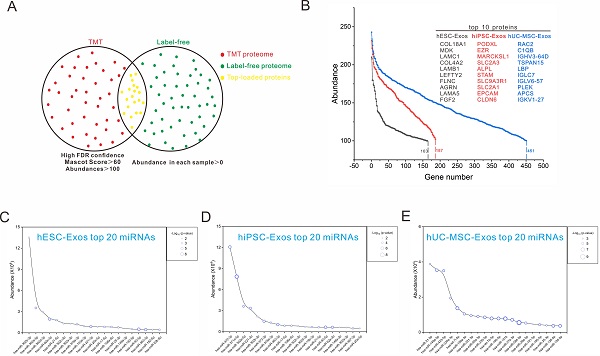
图. 3种人源干细胞外泌体中高峰度的蛋白组份和miRNA组份。
3种干细胞来源的外泌体组份参与调控了精细的生物学过程,比对分析发现 hESC-Exos在调控发育、代谢、抗衰老等方面具有显著优势,hiPSC-Exos具有和hESC-Exos相似的生物学功能,但其调控能力略逊于hESC-Exos。而hUC-MSC-Exos则在免疫调节方面表现突出。该研究首次系统地阐明了3种人源干细胞外泌体的蛋白组和miRNA组构成,绘制了其特有的蛋白组和miRNA组图谱,明确了其重点调控的生物学过程,拓展了现有的细胞外囊泡数据库,为3种干细胞外泌体在临床前或者临床试验中的单独或者联合使用提供了重要的理论基础。
中国科学院生物物理研究所姬广聚研究员为该论文的通讯作者。姬广聚课题组博士研究生毕友坤和硕士研究生乔新龙为该论文的共同第一作者。该研究得到国家重点研发计划、国家自然科学基金等项目的资助。
文章链接:https://stemcellres.biomedcentral.com/articles/10.1186/s13287-022-03142-1
(供稿:姬广聚研究组)
 附件下载:
附件下载: