新冠病毒大流行对全球的公共卫生构成重要威胁。目前对于新冠病毒感染影响宿主细胞生命活动的了解较为缺乏。内质网是真核细胞分泌蛋白和膜蛋白折叠和翻译后修饰的重要场所,对于冠状病毒的组装和成熟也十分重要。病毒劫持宿主细胞来合成自身的蛋白,从而增加了内质网的负担,引起内质网应激 (ER stress)。解析新冠病毒导致内质网应激的分子机制,对于我们理解新冠病毒致病性和高传染性,以及发掘潜在的干预手段和治疗方法十分重要。
2022年6月28日,中国科学院生物物理研究所王志珍/王磊课题组在Redox Biology发表题为"SARS-CoV-2 ORF8 reshapes the ER through forming mixed disulfides with ER oxidoreductases"的文章,揭示了新冠病毒辅助蛋白ORF8通过与内质网中的巯基氧化还原酶形成二硫键复合物逃逸降解,进而在内质网腔内累积引起宿主细胞内质网应激的分子机制。
新冠病毒的辅助蛋白ORF8与SARS病毒对应蛋白ORF8ab序列一致性仅为31%,是新冠病毒与SARS病毒序列相似度最低的蛋白质分子。研究人员首先确定ORF8是一个内质网腔定位的蛋白,通过蛋白质组学发现ORF8偏好与内质网的巯基氧化还原酶,如PDI和ERp44,形成分子间二硫键。正是通过这种策略ORF8逃避了内质网相关的降解并累积在内质网腔引起内质网应激,诱导内质网形成缠绕弯曲的异常形态,并加快分泌蛋白的运输。在B细胞成熟过程中,抗体大量合成会激活未折叠蛋白质响应(unfolded protein response, UPR)从而上调内质网蛋白质合成能力。有趣的是,ORF8具有类似免疫球蛋白结构域,因此ORF8就像是新冠病毒的"特洛伊木马",欺骗宿主细胞激活UPR,从而劫持内质网功能帮助病毒的包装与成熟。研究人员进一步发现小分子巯基还原剂可还原ORF8形成的分子间二硫键并加快ORF8降解,从而缓解内质网应激。
该研究揭示了新冠病毒辅助蛋白干扰宿主细胞内质网稳态的新机制。ORF8稳定性受氧化还原调控这一发现也为干预新冠病毒感染提供了新靶点和干预手段。
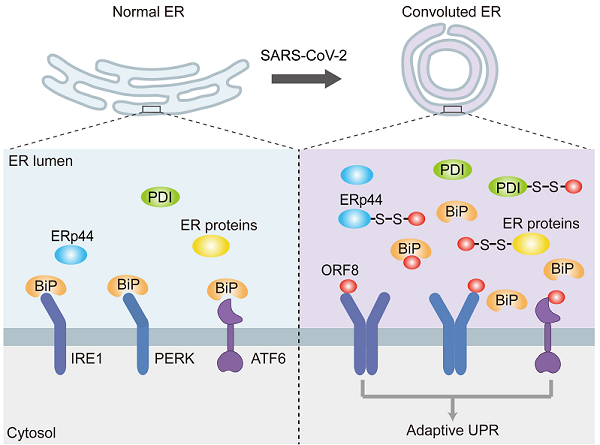
图:新冠病毒辅助蛋白ORF8引起内质网应激并重塑内质网形态
中科院生物物理所王磊研究员和王曦副研究员为论文的共同通讯作者,刘平博士(特别研究助理)为论文第一作者。该研究得到生物物理所张宏研究员、胡俊杰研究员和杨福全研究员团队的大力支持。研究工作受到国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项和中国科学院青年创新促进会的资助。
文章链接:https://www.sciencedirect.com/science/article/pii/S2213231722001604
(供稿:王志珍/王磊研究组)
 附件下载:
附件下载: