先天免疫是宿主细胞抵抗病毒、细菌等病原体入侵的防御机制,在此防御过程中溶酶体依赖于其内部的水解酶分解入侵的病原体,因此增加细胞内溶酶体的数量能够提高宿主的先天免疫防御能力。已有的研究报道TFEB是调控溶酶体生物合成的关键转录因子,在非应激状态下TFEB依赖于蛋白激酶mTOR介导的磷酸化与锚定蛋白14-3-3结合,表现出胞质定位;在应激状态下,例如,营养物质剥夺、氧化应激以及病原体入侵等条件下,TFEB脱离14-3-3的锚定,随之从胞质转移至细胞核内。在细胞核内TFEB激活参与溶酶体生物合成的基因表达,进而诱导溶酶体的生物合成。
衣康酸(itaconate)是一种具有抗炎功能的三羧酸循环代谢产物,在线粒体基质中借助代谢酶IRG1的催化活性由顺乌头酸(cis-aconitate)转化而来。从分子结构角度看,衣康酸是一种含有烯基的不饱和羧酸,具有很强的亲电子活性,能够通过thia-Michael加成反应将蛋白质半胱氨酸残基烷基化。2022年6月3日,中国科学院生物物理研究所李新建研究团队在《Molecular Cell》杂志上在线发表了题为 Itaconate is a lysosomal inducer that promotes antibacterial innate immunity (DOI: https://doi.org/10.1016/j.molcel.2022.05.009) 的研究论文。该研究揭示了巨噬细胞在抵御细菌入侵过程中通过激活代谢酶IRG1的表达产生衣康酸,随后的质谱鉴定结果发现衣康酸烷基化(alkylation)修饰TFEB Cys212位点,鉴于Cys212邻近 Ser211,Cys212烷基化修饰阻止了蛋白激酶mTOR介导的Ser211磷酸化并破坏已被磷酸修饰的TFEB与14-3-3结合,导致TFEB从胞质转移至细胞核,进而激活溶酶体的生物合成,提高巨噬细胞抵御细菌入侵的能力。为了进一步证实衣康酸介导的TFEB烷基化修饰能够提高机体的抗菌先天免疫能力,研究人员运用基因编辑技术将小鼠TFEB烷基化修饰位点由半胱氨酸突变成丝氨酸,结果显示在伤寒沙门氏菌感染模型中,TFEB烷基化修饰缺陷型小鼠比野生型小鼠的存活时间明显缩短、体内器官荷菌数量明显增多;进一步的实验结果表明:给野生型小鼠注射具有膜通透性的衣康酸衍生物4-辛酯衣康酸(OI)可显著延长伤寒沙门氏菌感染小鼠的生存时间,提示衣康酸介导的TFEB烷基化修饰是维持机体抗细菌感染能力的重要途径。综上所述,该研究成果揭示了在被细菌感染的条件下,衣康酸能够诱导巨噬细胞溶酶体的生物合成,进而增强机体抗菌先天免疫的能力。因此,该研究拓展了衣康酸抗炎以外的生物学功能。
中国科学院生物物理研究所博士后张振兴、陈超为该论文的共同第一作者,李新建研究员为该论文的唯一通讯作者。该研究得到了国家自然科学基金委、中国科学院和国家重点研发计划的经费支持。
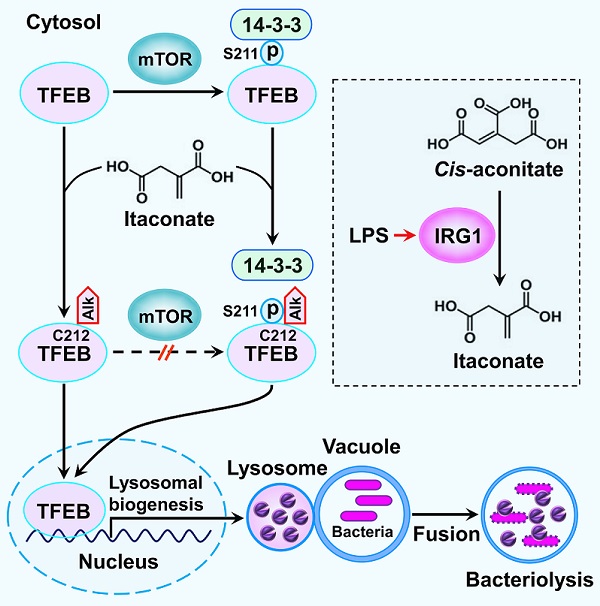
图. 在细菌感染的条件下,脂多糖(LPS)激活的巨噬细胞表达衣康酸合成酶IRG1,在线粒体中IRG1将顺乌头酸(cis-aconitate)转化为衣康酸(itaconate)。随后衣康酸在胞质中对转录因子TFEB进行烷基化修饰,该修饰能够阻止蛋白激酶mTOR对TFEB进行磷酸化修饰并破坏已被mTOR磷酸化修饰的TFEB与14-3-3结合,导致TFEB从胞质转移至细胞核。在细胞核内TFEB激活溶酶体的生物合成,提高巨噬细胞清除入侵细菌的先天免疫能力。
文章链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(22)00443-9
(供稿:曾益新/李新建研究组)
 附件下载:
附件下载: