2022年3月8日,中国科学院生物物理研究所柯莎课题组在英国皇家化学会《Nanoscale》杂志上发表题为"Distinct lipid membrane-mediated pathways of Tau assembly revealed by single-molecule analysis"的研究论文。该论文报道了利用单分子荧光技术研究磷脂膜对人源Tau蛋白分子内构象和纤维化动力学的影响,揭示了膜介导的Tau蛋白的不同组装机制,及其与Tau-磷脂膜互作的功能性和致病性的可能联系。
Tau是一类微管结合蛋白,主要参与细胞骨架中微管的组装和稳定。Tau蛋白的异常聚集与包括阿尔兹海默症在内的多种神经退行性疾病密切相关,但对于促发其细胞内聚集的机制尚无定论。研究表明,磷脂膜能够与细胞内的Tau蛋白发生互作,正常生理条件下,Tau蛋白与膜的互作与细胞器定位以及信号转导等过程相关;另一方面,Tau与磷脂膜的互作也被认为是细胞内诱发Tau蛋白淀粉样聚集的重要因素,同时Tau蛋白的寡聚体可进一步导致膜结构的破坏,引发细胞凋亡,导致退行性疾病的发生。目前,对于磷脂膜如何诱导Tau蛋白分子内的构象改变进而促进分子间聚集的机制尚未得到充分研究。阐明上述问题,对理解疾病的发病机制和相关药物的研发至关重要。
单分子荧光技术能够探测生物大分子构象状态的亚组分分布及其动态转化,并且能够捕捉不稳定、不均一的分子间寡聚体组分,是研究淀粉样蛋白构象变化与聚集机制的重要手段。在本论文中,研究人员利用单分子FRET技术和荧光相关光谱(FCS)技术,探究了Tau蛋白与磷脂酰丝氨酸(DMPS)构成的囊泡互作过程中发生的分子内变构和分子间寡聚化,单分子实验结果显示,DMPS脂双层膜可引发Tau蛋白N端和C端结构域打开,暴露纤维化核心区,转变为具有聚集倾向的构象。而Tau蛋白的分子间寡聚化行为则与DMPS浓度相关:低DMPS浓度下,具有聚集倾向的构象的Tau蛋白形成寡聚体,加速Tau蛋白的纤维化;高DMPS浓度下,Tau蛋白的构象伸展程度增加,以低密度的状态与膜结合,从而抑制纤维化发生。该研究表明Tau蛋白天然态"paperclip"构象对于维持其稳定性具有重要作用,揭示了Tau蛋白的寡聚化、以及纤维化的加速及抑制均与Tau蛋白和膜脂的比例存在相关性,为进一步揭示Tau蛋白与磷脂膜互作的功能性和致病性差异提供了新线索。
中国科学院生物物理研究所吴思副研究员为本文通讯作者,柯莎课题组已毕业博士生姚琼琼和温纪涛为本文的共同第一作者,柯莎研究员对本工作进行了重要的指导。该研究获得国家自然科学基金、国家重点研发计划等项目支持。
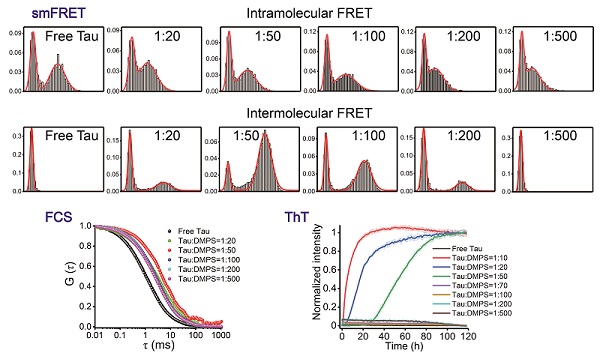
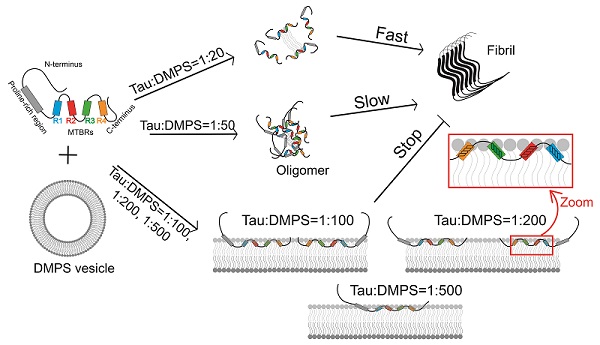
图1:单分子FRET和FCS技术揭示磷脂双层膜诱导Tau蛋白发生的分子内构象变化及其对Tau蛋白聚集的影响。
文章链接:https://pubs.rsc.org/en/Content/ArticleLanding/2022/NR/D1NR05960B
(供稿:柯莎研究组)
 附件下载:
附件下载: