肝癌居世界肿瘤相关第三位死因。HBV感染是我国原发性肝癌最主要的致病因素。作为这种慢性感染性肝炎导致的肿瘤,HBV相关肝癌具有与其他类型截然不同的发病机制和治疗特点。例如肝癌晚期一线药物索拉非尼在HBV单阳性肝癌中疗效不显著(Jackson et al. J Clin Oncol. 2017);HBV感染还与肝癌门静脉癌栓等血管转移密切相关。如何打破HBV相关肝癌的免疫耐受,寻求靶向T细胞免疫治疗新靶点,有着重要的科研意义及临床应用价值。
2021年9月12日,中国科学院生物物理研究所杨鹏远课题组与解放军总医院第五医学中心王福生课题组合作在《Journal of Hepatology》杂志发表题为"Intratumoral stem-like CCR4+ regulatory T cells orchestrate the immunosuppressive microenvironment in HCC associated with hepatitis B"的研究论文,阐述了瘤内CCR4介导调节性T细胞(Treg)促进HBV相关肝癌免疫逃逸新机制,揭示了CCR4+ Treg亚群的干细胞样表观遗传调控特征,为HBV相关肝癌的防治提供了新的理论基础和干预策略。
课题组多年来持续关注于HBV相关肝癌中负向免疫调节功能Treg细胞的聚集机制。前期研究发现,HBV通过活化TGF-β信号促进趋化因子CCL22表达,诱发Treg细胞迁移至肿瘤组织区域,介导免疫逃逸(Cancer Cell,2012)。在索拉非尼治疗的HBV相关肝癌中通过激活TNFα/RIP1/NF-κB信号通路显著上调CCL22,招募Treg细胞促进索拉非尼耐药;拮抗CCL22信号通路可打破索拉非尼耐药,有助于解决HBV相关肝癌治疗中一线药物耐药的难题(Pharmacol Res, 2020)。HBV感染通过HBx促进ERK信号下游趋化因子CXCL8(IL-8)表达,通过其受体CXCR1在肝血窦内皮中特异激活肝内TGF-β信号,促进肝内Treg浸润和血管转移(Cancer Res, 2021)。
本文中研究人员在HBV相关肝癌临床标本及小鼠原位肝癌荷瘤模型等检测到癌组织特异性浸润的Treg细胞高表达趋化因子CCL22受体CCR4,并与HBV滴度及预后显著相关。利用可接近染色质测序(ATAC-seq)及多数据库平台分析发现,这群肿瘤浸润的CCR4+ Treg细胞在TCF7和PD-1染色质区域更加开放,显著上调TCF7转录因子活性,表现出干细胞样表观遗传调控特征。功能研究发现,相较CCR4- Treg,CCR4+ Treg免疫抑制功能更强,通过分泌高水平IL-10、IL-35等抑制杀伤性T细胞功能,促进肿瘤免疫逃逸。利用拮抗剂及自主研发合成的N端融合蛋白靶向CCR4治疗可以显著抑制肿瘤生长,与索拉非尼、PD-1抑制剂等联用可打破药物耐药性,增强免疫治疗效果。值得关注的是,这种靶向CCR4+ Treg能显著抑制瘤内的免疫耐受,但不影响机体正常免疫组织中Treg细胞稳态的维持,避免免疫过度活化等副作用的发生。因此,CCR4可作为一种特异靶向HBV相关肝癌免疫逃逸和肝癌血管转移的药物治疗靶点。
相关研究受邀在Natl Sci Rev、Pharmacol Res杂志发表综述总结该领域进展。基于CCR4在肿瘤免疫治疗中的作用和靶标申请了发明专利3项,其中CCR4-N端重组蛋白作为新药转化处于药企临床前工作中,有望为我国人群高发的HBV相关肝癌提供新型的免疫治疗药物。
该工作由中国科学院生物物理研究所、重庆国际免疫研究院、解放军总医院第五医学中心和威尔康奈尔医学院多家单位合作完成。中国科学院生物物理研究所杨鹏远研究员和解放军总医院第五医学中心王福生院士为本文的共同通讯作者,中国科学院生物物理研究所副研究员高雅楠、博士生游茂军和解放军总医院第五医学中心福军亮博士为本文共同第一作者。该研究得到国家自然科学基金委、中国科学院和重庆国际免疫研究院的经费支持。
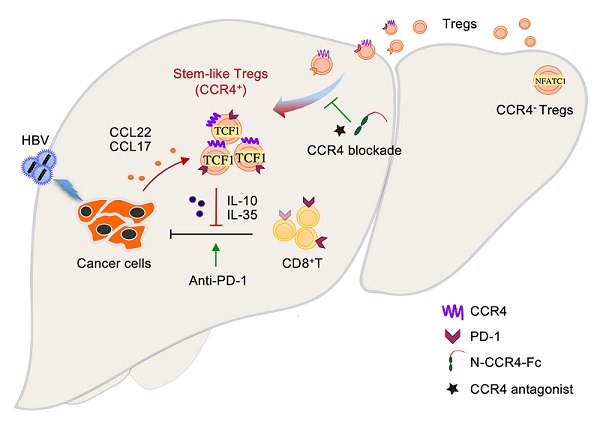
图1. CCR4介导Treg促进HBV相关肝癌免疫逃逸新机制模式图.
文章链接:https://doi.org/10.1016/j.jhep.2021.08.029
参考文献:
1. Gao Y#, You M#, Fu J#, Tian M, Zhong X, Du C, Hong Z, Zhu Z, Liu J, Markowitz GJ, Wang FS*, Yang P*. Intratumoral stem-like CCR4+ regulatory T cells orchestrate the immunosuppressive microenvironment in HCC associated with hepatitis B. Journal of Hepatology. 2021; doi: 10.1016/j.jhep.2021.08.029
2. Yang P, Li QJ, Feng YX, Zhang Y, Markowitz GJ, Ning S, Deng Y, Zhao J, Jiang S, Yuan Y, Wang HY, Cheng SQ, Xie D*, Wang XF*. TGF-β-miR-34a-CCL22 signaling-induced Treg cell recruitment promotes venous metastases of HBV positive hepatocellular carcinoma. Cancer Cell. 2012; 22(3): 291-303.
3. Gao Y#, Fan X#, Li N#, Du C, Yang B, Qin W, Fu J, Markowitz GJ, Wang H, Ma J*, Cheng S*, Yang P*. CCL22 signaling contributes to sorafenib resistance in hepatitis B virus-associated hepatocellular carcinoma. Pharmacol Res. 2020 Jul; 157: 104800.
4. Zhang C#, Gao Y#, Du C#, Markowitz GJ#, Fu J#, Zhang Z, Liu C, Qin W, Wang H, Wang F*, Yang P*. Hepatitis B-induced IL-8 Promotes Hepatocellular Carcinoma Venous Metastasis and Intrahepatic Treg Accumulation. Cancer Res. 2021 May 1; 81(9): 2386-2398.
5. Yang P#, Markowitz GJ#, Wang XF*. The hepatitis B virus-associated tumor microenvironment in hepatocellular carcinoma (Review). Natl Sci Rev. 2014; 1(3): 396-412.
6. Jia L, Gao Y, He Y, Hooper JD*, Yang P*. HBV induced hepatocellular carcinoma and related potential immunotherapy (Review). Pharmacol Res. 2020 Sep; 159: 104992.
(供稿:杨鹏远研究组)
 附件下载:
附件下载: