2021年4月12日,中国科学院生物物理所李栋课题组与牛津大学Marco Fritzsche课题组以及伦敦大学学院Emad Moeendarbary课题组合作在Nature Communications杂志同期发表题两种生物力显微成像方法的论文,Astigmatic traction force microscopy (aTFM)和Two-dimensional TIRF-SIM-traction force microscopy (2D TIRF-SIM-TFM)。提出了两种新型生物力显微成像方法:像散牵引力结构光照明超分辨显微镜(aTFM-SIM)和二维全反射结构光超分辨牵引力显微镜(2D TIRF-SIM-TFM),可对细胞生命活动过程中与周围环境的相互作用力进行二维或三维、高速、长时程、超分辨率观测,并利用这两种技术研究了大鼠嗜碱细胞白血病(RBL)细胞免疫激活和哺乳动物细胞迁移等过程中的作用力,及其与细胞内微丝骨架动态形变的关联。
生物力学(mechanobiology)是研究生命活动中相关力学特性的学科。细胞的生物力学特性与生命活动的许多功能相关,比如肿瘤免疫过程、器官的衰老、皮肤和伤口愈合、血管形成、淋巴功能、骨骼、神经元和眼睛活动等生命过程。这些微观力学过程通常发生在亚微米、皮牛和亚秒尺度。牵引力显微镜(traction force microscopy)是最广泛应用于生物力学研究的技术之一,其利用弹性物质表面的荧光微球探针观测细胞和弹性物质互作过程中的微观作用力。但是传统的牵引力显微镜受限于获取微球位移的精度和速度,只能以稀疏的荧光微球作为探针进行慢速的微米尺度二维观测,应用范围大幅度受限。
针对传统牵引力显微镜只能二维观测的缺点,基于李栋课题组开发的三维结构光超分辨显微镜(3D-SIM)对荧光微球探针和生物样品进行超分辨观测,高精度确定荧光微球的三维位置,李栋和Marco Fritzsche合作团队已开发完成第一代三维牵引力显微镜(3D-SIM-TFM,Nano Letters,2019, 19(7): 4427-4434)。由于3D-SIM-TFM通过多层扫描得到微球的三维位置坐标,所以三维生物力测量的速度依然受限。针对这一瓶颈,合作团队提出基于柱透镜像散的力追踪显微成像方法aTFM-SIM(图1)。aTFM-SIM无需机械扫描仅单次曝光即可高精度追踪荧光微球探针的三维位置,从而计算出细胞表面三维作用力分布。aTFM-SIM的时间分辨率和轴向力追踪精度比3D-SIM-TFM分别提高5倍和10倍。合作团队进一步利用aTFM-SIM以高时、空和力精度观测了RBL细胞的免疫反应过程(图2),以及宫颈癌细胞(HeLa)的贴壁伸展过程。
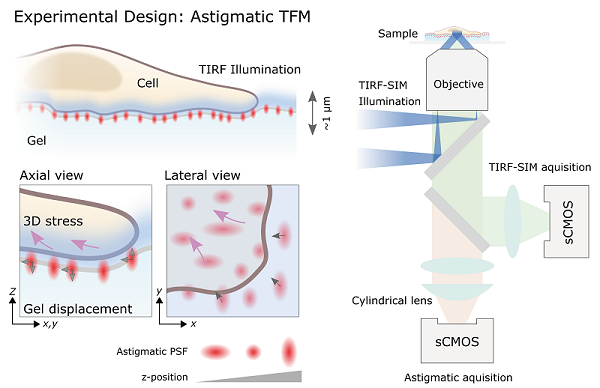
图1. aTFM-SIM生物力测量方法示意图。
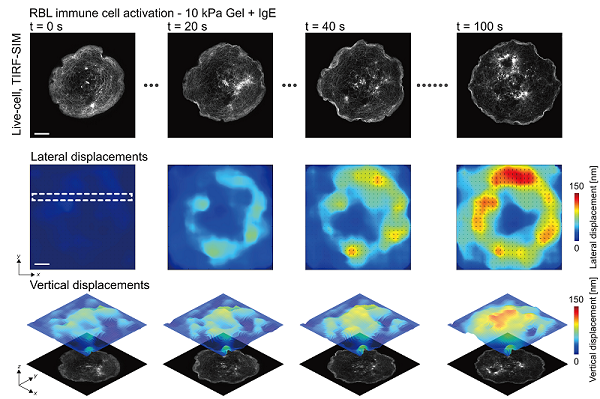
图2. aTFM-SIM活细胞成像观测RBL细胞免疫反应过程中的生物力,及其与微丝动态形变的关联。
aTFM-SIM可以有效研究微米尺度、秒量级和几十皮牛大小微观力学互作过程,但是生命活动过程中也存在大量更快速和更为小的微观力学作用,并且使用二维成像也能观测部分生命活动过程。为了进一步提升观测的时空精度,研究人员使用全反射结构光超分辨显微镜(TIRF-SIM)和牵引力显微镜相结合开发出2D-TIRF-SIM-TFM显微成像方法,并利用粒子图像测速(PIV)算法取代传统的单颗粒追踪算法分析荧光微球探针的位移,可以分析更加密集的荧光微球探针,微球密度提升15~20倍,最终可有效探测几十纳米尺度,亚秒量级和皮牛大小的微观力学互作。相较传统牵引力显微镜,2D-TIRF-SIM-TFM的空间和时间分辨率分别提升2倍和10倍以上。合作团队观测发现2D-TIRF-SIM-TFM能有效解析原代鲑鱼角质细胞迁徙过程中的类旋涡状动态互作,而传统牵引力显微镜却不能(图3)。

图3. 原代鲑鱼角质细胞迁徙过程中的微小位移的观测结果,2D-TIRF-SIM能清晰观测到旋涡状的作用力产生过程。
论文1(aTFM-SIM)的共同通讯作者为伦敦大学学院Emad Moeendarbary教授、中科院生物物理所李栋研究员和牛津大学Marco Fritzsche教授,共同第一作者为中科院生物物理所副研究员李迪、牛津大学博士后Huw Colin-York、博士生Liliana Barbieri和伦敦大学学院博士后Yousef Javanmardi,中科院生物物理所博士后郭玉婷为第二作者。
论文2(2D-TIRF-SIM-TFM)的共同通讯作者为中科院生物物理所李栋研究员和Marco Fritzsche教授,该论文共同第一作者为牛津大学的博士生Liliana Barbieri,博士后Huw Colin-York和博士后Kseniya Korobchevskaya,中科院生物物理所副研究员李迪为该文的第二作者。
上述研究工作得到了国家自然科学基金委、科技部、中国科学院、中国博士后科学基金的资助。
文章链接:
https://www.nature.com/articles/s41467-021-22376-w
https://www.nature.com/articles/s41467-021-22377-9
(供稿:李栋研究组)