G蛋白偶联受体(GPCR)是非常重要的药物靶点,在人类基因组中编码800多种,约30%的临床处方药的直接靶点是GPCR。GPCR在行使功能时通常伴随着分子构象发生变化,因此理解GPCR构象变化非常重要。近年来,结构学生物学研究方法的进步为研究GPCR的功能提供了良好的基础。目前研究GPCR结构的常用方法主要有:晶体学、NMR、冷冻电镜。通过晶体或电镜结构所获得的信息,对于GPCR结构和功能的理解往往只能从静态水平出发,很难捕获GPCR构象动态转换的动力学过程以及与下游蛋白相互作用时的瞬时调节过程。
NMR 光谱是研究GPCR动态构象的方法之一,此前我们基于19F-NMR 揭示了GPCR调控arrestin 构象及功能的磷酸选择机制,创新性的提出了"笛子模型"。尽管19F-NMR 具有独特的优越性,但是由于膜蛋白低表达量,低信噪比以及NMR 本身的局限性,使得NMR 在研究高分子量的膜蛋白复合物中仍面临挑战。
2020年9月25日,中国科学院生物物理研究所王江云研究员团队和山东大学基础医学院孙金鹏教授团队通力合作,在《Nature Communications》发表了题为"DeSiphering receptor core-induced and ligand-dependent conformational changes in arrestin via genetic encoded trimethylsilyl1H-NMR probe"的研究论文,该研究借助高效灵敏的NMR探针-TMSiPhe 和950 MHz 1D 1H-NMR 阐明了配体直接通过GPCR跨膜螺旋核心区域选择性调控Arrestin不同构像的作用机制。
研究者利用基因密码子扩展技术将4-三甲基硅基苯丙氨酸(TMSiPhe) 特异性标记到蛋白质中,并通过晶体学分析解释了TMSiPheRS 对TMSiPhe 的选择性识别机制,然后借助950 MHz 1D 1H-NMR测定不同配体作用下GPCR调控下游蛋白arrestin的多重构象状态。TMSiPhe特有的1H-NMR化学位移和高灵敏度特性,在低蛋白浓度(5μM),短时间(10分钟)即可获得高质量的NMR 光谱。这种高效、简便的方法可广泛应用于高分子量的膜蛋白复合物构象动态变化的研究。
山东大学基础医学院博士生刘琪、贺庆涛,博士后杨帆,生物物理研究所博士后吕晓璇和中国科学技术大学高级工程师朱中良为本篇论文的共同第一作者;孙金鹏教授和王江云研究员为共同通讯作者。
该研究得到科技部国家重点研发计划、国家自然科学基金等项目的资助和支持。
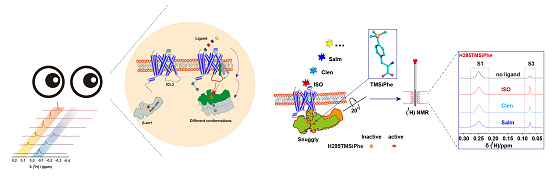
图. TMSiPhe 和950 MHz 1D 1H-NMR测定不同配体作用下的GPCR调控arrestin的多重构象状态
文章链接:https://www.nature.com/articles/s41467-020-18433-5
(供稿:王江云研究组)
 附件下载:
附件下载: