2020年8月13日,《Science China-Life Sciences》在线发表了中国科学院生物物理研究所王晓群课题组和北京师范大学吴倩课题组合作研究论文"Loss of the centrosomal protein Cenpj leads to dysfunction of the hypothalamus and obesity in mice"的研究论文。该工作阐明了中心体蛋白Cenpj对下丘脑神经发生和摄食环路的调控作用。
下丘脑由间脑发育而来,在调节食欲、体重、脂肪和葡萄糖稳态以及能量消耗等方面发挥着重要作用。其中的弓状核(ARC)被认为是大脑的"摄食中枢",两种典型的弓状核神经元:神经肽 Y(NPY)及刺痛相关肽(AgRP)神经元促进进食,而表达黑素皮质素(POMC)的神经元根据周围营养和激素信号对进食产生反作用。这两种神经元共同整合能量稳态信号来调节摄食和稳态。NPY/ AgRP神经元和POMC神经元之间不仅彼此相互作用,而且它们的轴突会向大脑的其他区域投射,例如下丘脑的室旁核 (PVN)。PVN神经元表达调节能量平衡的黑素皮质素 4 受体 (MC4R)。POMC 神经元合成并分泌厌食刺激激素肽(α-MSH)以激活 PVN 中 MC4R 神经元并抑制食物摄入。相反的是,AgRP/NPY 神经元充当 MC4R的反向激动剂,促进食物摄入。这些不同核团的神经元投射的发展变化对成年人的体重产生深远的影响。
Cenpj是一种位于中心体和纤毛基底的中心体蛋白,我们前期的研究表明Cenpj在调控神经发生和大脑皮层发育中起重要作用(Ding et al, 2019)。尽管中心体和纤毛功能障碍是引起肥胖和II型糖尿病的病因之一,但Cenpj在体重调节中所起的作用仍不清楚。
研究人员利用Nkx2.1-Cre在小鼠端脑腹侧特异性敲除Cenpj基因后得到Cenpj条件性敲除鼠(CenpjCKO),该小鼠在4个月左右表现进食增加、代谢减弱,最终引起肥胖。研究发现小鼠在胚胎发育期,下丘脑的干细胞增殖减少,并伴随有细胞凋亡的现象,从而引起CenpjCKO小鼠中调控进食和能量代谢的两个重要的核团(ARC和PVN)变小,弓状核ARC中POMC神经元的数量急剧减少,并且NPY神经元的电生理功能发生障碍。同时,ARC到PVN的神经投射减少,PVN神经元中MC4R表达也降低。该研究详细阐明了中心体蛋白Cenpj在Nkx2.1表达的干细胞中缺失后,影响下丘脑的发育的生物学机制:一方面使在ARC中的抑制食物摄入的POMC细胞数量变少,这可能会减少作用于PVN神经元中MC4R的α -MSH,最终阻断正常的食物摄入抑制。另一方面, NPY/AgRP神经元表现出较高的活性,可能导致MC4R的激动剂NPY/AgRP释放到PVN的神经元,并通过作用于下游受体刺激食物摄入(图1)。这项研究解析了Cenpj在调控下丘脑发育和体重调节方面的作用,为深入了解相关疾病的病理机制奠定了基础。
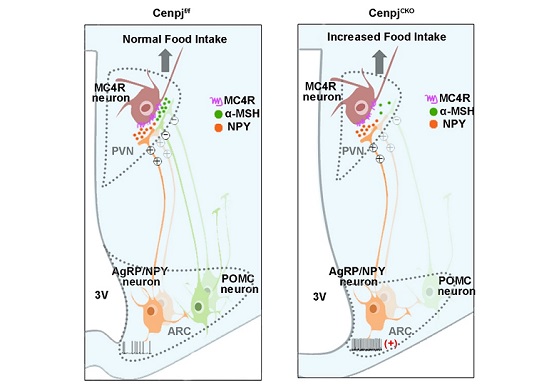
图1. 中心体蛋白Cenpj的缺失导致小鼠下丘脑功能障碍和肥胖的发生
该工作由北京师范大学和中国科学院生物物理研究所合作完成。北京师范大学吴倩教授和中国科学院生物物理研究所王晓群研究员同为本文的共同通讯作者,北京师范大学的博士后丁文玉博士及中国科学院生物物理研究所的博士研究生张长江为本文的第一作者。本研究受到国家重点研发计划、国家自然科学基金、中科院先导计划、脑科学与类脑研究北方科学中心科研项目等经费的支持。
文章链接:
https://engine.scichina.com/publisher/scp/journal/SCLS/doi/10.1007/s11427-020-1767-5?slug=fulltext
参考文献:
Ding W, Wu Q, Sun L, Pan NC, Wang X. Cenpj regulates cilia disassembly and neurogenesis in the developing mouse cortex. Journal of Neuroscience. 2019 Mar 13;39(11):1994-2010.
(供稿:王晓群研究组)
 附件下载:
附件下载: