2020年7月17日,《Nature Communications》杂志在线发表了中国科学院生物物理研究所章新政研究组的研究论文"Cryo-EM analysis of the post-fusion structure of the SARS-CoV spike glycoprotein"。这项工作通过解析冠状病毒SARS-CoV spike(S)糖蛋白的融膜后结构,进一步阐释了冠状病毒的融膜机制,为相关疫苗和药物的开发设计提供了结构基础和指导思路。
高致病性人源冠状病毒所引发的疾病已经对人类生命健康造成了巨大威胁,然而目前仍然缺乏有效的防治手段。鉴于RNA病毒在病毒复制过程中更容易突变,以及目前仍然未知的其他冠状病毒,人们急需找到更广泛的预防和治疗手段,以应对冠状病毒引起的紧急事件。冠状病毒S糖蛋白是病毒表面的主要抗原成分和重要药物靶点,其S2亚基作为融膜机器,介导了病毒与宿主之间的膜融合过程。目前多数针对冠状病毒糖蛋白的研究集中在其融膜前构象,而由于较难获得糖蛋白融膜后构象,三种高致病性人冠状病毒的糖蛋白融膜中或融膜后结构均处于未知状态。解析糖蛋白融膜后结构能够帮助了解冠状病毒的融膜机制,进而开发阻断融膜过程的抗体和抑制剂,打断病毒传播及感染的关键步骤。另一方面,鉴于糖蛋白融膜机器S2亚基的高度保守性,对S2亚基的结构生物学研究或许能为开发广谱性的疫苗及药物提供新的思路。因此章新政研究组就此开展研究,通过在体外环境中模拟融膜过程,成功获得了SARS-CoV糖蛋白的融膜后样品并解析了其空间结构。
SARS-CoV S糖蛋白的融膜后结构仍以三聚体形式存在。与融膜前结构相比,S2亚基完成融膜后变形延伸了约80 Å,使S2融膜后机器整体呈长棒状结构(Fig.1)。其中关键性变化在于HR1(heptad repeat 1)和中心螺旋CH(central helix)由分散的短螺旋,变形重组成为一整根长螺旋,这一变化保证了融膜肽FP(fusion peptide)弹出并插入到靶细胞膜内。随后HR2元件及其上游连接区域与中心螺旋束以反向平行的方式结合,这一构象变化保证了病毒膜与靶细胞膜的拉近及融合。此外,研究者发现HR2上游连接区域在融膜前结构中被折叠并稳定结合在近病毒包膜端,而在融膜后结构中这段区域被释放出来,形成主要以loop区域组成的高度延伸的结构,通过与中心螺旋束之间结合,将近病毒包膜端的HR2元件拉近到靶细胞膜附近的HR1元件处,从而实现了HR1-HR2六螺旋束的形成,最终介导了病毒包膜与靶细胞膜之间的融合。
在SARS-CoV S2融膜机器的融膜后结构中,研究者成功指认了24个N-糖基化修饰位点(Fig.1d)。通过序列保守性分析发现,这些糖基化修饰位点在冠状病毒中是高度保守的。此外,基于S2亚基的序列高度保守性,针对S2亚基开发疫苗或设计抑制药物,或可用于广谱性抗冠状病毒治疗。目前已有研究报道多个针对SARS-CoV S2亚基的抗体能够抑制不同物种来源的SARS-CoV或其突变体进入细胞。研究者通过定位已报到的针对S2亚基的抗体及抑制剂的结合位点,结合SARS-CoV S2融膜后结构,进一步分析了潜在的抗病毒靶点。
这项工作由中国科学院生物物理研究所章新政研究组完成。章新政研究员和曹端方副研究员是该论文的共同通讯作者,博士研究生范晓益和曹端方副研究员是该论文的共同第一作者。这项工作得到了国家自然科学基金和中科院青年创新促进会的资助和支持。
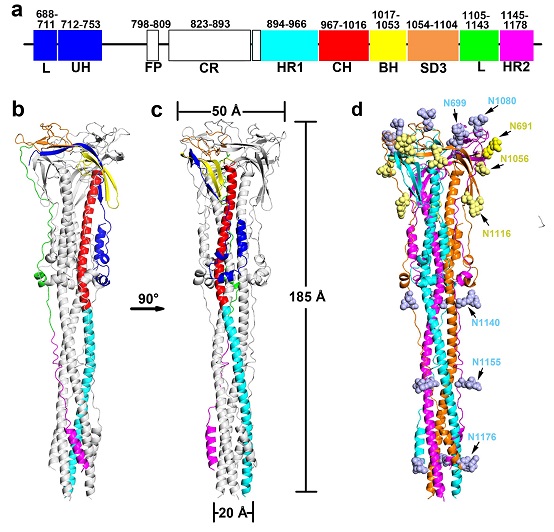
Figure 1. SARS-CoV S糖蛋白的融膜后结构及糖基化位点分布。
文章链接: https://www.nature.com/articles/s41467-020-17371-6
((供稿:章新政研究组)
 附件下载:
附件下载: