2019年11月28日,中国科学院生物物理研究所孙飞课题组与德国马普研究所Hartmut Michel课题组在国际著名期刊《Angewandte Chemie》杂志上以封面文章联合发表了题为“A 3.3 angstrom-Resolution Structure of Hyperthermophilic Respiratory Complex III Reveals the Mechanism of its Thermal Stability”的研究成果。该项工作首次报道了来自超嗜热菌的呼吸链复合物III天然状态和结合抑制剂后的高分辨率冷冻电镜结构,鉴定出一系列能显著增强蛋白稳定性的新型结构特征,从而在原子水平上揭示了呼吸链复合物在极端环境下仍能稳定发挥生理功能的结构基础。
呼吸作用是生命体内最基础的能量代谢活动之一,主要由四个大分子量的呼吸链蛋白复合物完成。呼吸链复合物的功能失活会导致帕金森氏症、阿尔茨海默氏症、多发性硬化、少年脊髓型共济失调以及肌萎缩性脊髓侧索硬化症等多种疾病,因此维持其结构完整和生物活性对于生命体是至关重要的。生活在极端环境中的生命体,如高辐射、高压、高温等,其呼吸链复合物能否维持生物活性是其能否生存的关键。然而,由于缺少来自超嗜热物种呼吸链复合物的结构信息,它们在极端环境下如何维持其结构和功能的完整性仍然是未知的。
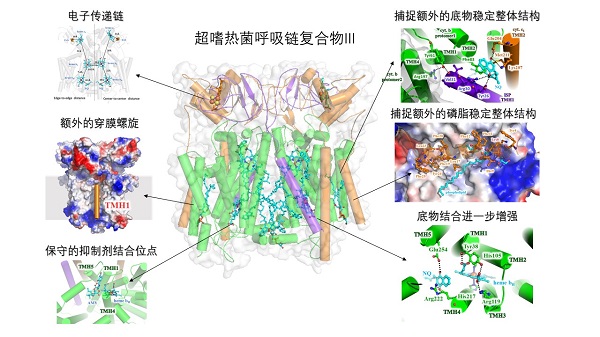
Aquifex aeolicus 是细菌最古老的分支、最嗜热的菌之一,最适生长温度85-95°C。它广泛分布在世界各地的高温液体环境中,包括陆地和海洋,能适应多种极端环境。生长在高温环境,要求生物体内的蛋白质、核酸、磷脂等适应极端条件,所以A. aeolicus是一种研究嗜热蛋白结构和功能关系的理想生物。其呼吸链复合物III在前期的生化及光谱实验已展现出独特之处,非常稳定、耐热。孙飞课题组与Hartmut Michel课题组经过多年合作,最终利用冷冻电镜单颗粒技术成功解析了A. aeolicus呼吸链复合物III天然状态和结合抑制剂的三维结构,分辨率均达到了3.3埃。该结构是首个超嗜热菌的呼吸链复合物III的高分辨率三维结构。通过序列比对和三维结构分析,研究团队鉴定出一系列能显著增强蛋白稳定性的新型结构特征,发现了数个嗜热菌特有的氨基酸以及一条额外的跨膜螺旋,它们能使配体结合更加稳定、亚基间相互作用增强。而且,这个呼吸链复合物还通过牢牢抓住一个醌分子和磷脂分子进一步增强了蛋白在膜脂上的稳定性。这些发现揭示了复合物III处于极端环境中仍能保持稳定活性的结构基础,为之后研究和利用极端环境中蛋白质的稳定性提供了重要的理论依据和试验数据。
中科院生物物理所孙飞研究员、朱赟副研究员和德国马普所Hartmut Michel教授、彭国宏博士为本文的共同通讯作者,孙飞课题组朱国梁、张双博和Hartmut Michel课题组曾辉为本文共同第一作者。该研究得到国家自然科学基金、国家重点研究开发项目等基金的资助。数据收集等工作得到了生物物理所生物成像中心(黄小俊、朱博玲等)的大力支持和帮助。
文章链接:https://doi.org/10.1002/anie.201911554
(供稿:孙飞研究组)
 附件下载:
附件下载: