2019年10月29日,《Journal of Cell Biology》杂志在线发表了中国科学院生物物理研究所张宏课题组的研究论文“TGFβ-like DAF-7 acts as a systemic signal for autophagy regulation in C. elegans”,该文揭示了在线虫中,TGFβ蛋白DAF-7协同调控多种组织中细胞自噬的活性。
自噬是一种进化上保守的由溶酶体介导的降解过程,包括形成双层膜自噬体,进而包裹一部分细胞质,并将其输送到溶酶体进行降解。在多细胞生物中,自噬调节多种生理功能,如抗应激、细胞命运决定和组织重塑。酵母和体外细胞系中的研究鉴定了多个感应各种应激条件进而调节自噬活性的因子。在多细胞生物中,不同组织/器官之间可以协同调控以应对外界刺激,进而从机体水平上确保细胞稳态的维持。同样自噬活性的调节也是系统性的,可以改善因局部胁迫(如营养限制)引起的有害影响,并维持细胞/组织/机体的稳态。例如,果蝇眼睛中的恶性肿瘤不仅能在肿瘤微环境中诱导自噬,在远端组织(包括肠道、脂肪组织和肌肉)中也可以诱导自噬活性。然而,从整体水平调控远端细胞/组织/器官的自噬活性的信号通路仍然未知。
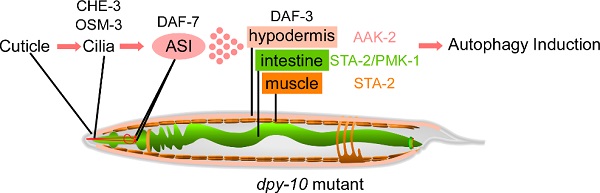
图示:dpy-10类基因调控自噬活性的模式图
秀丽隐杆线虫被一种称作角质层(cuticle)的结构包裹,起到与外部环境分隔的不透水屏障的作用。角质层是一种多层细胞外基质,主要由交联胶原蛋白组成。角质层的外层为交替的平行圆周带,称为环节和环节沟,它们由两组不同的胶原蛋白组成。环节沟胶原蛋白基因如dpy-2、-7和-10缺失会导致角质层完整性缺陷。在该研究中,我们发现线虫发育过程中,角质层的环节沟胶原蛋白缺失会上调表皮、肠道和肌肉组织的自噬活性。进一步研究发现这种系统性调控自噬活性的过程依赖感觉神经元纤毛的功能。在环节沟胶原蛋白缺失突变体中,具有纤毛的ASI感觉神经元感应角质层的变化,进而ASI分泌TGFβ分子DAF-7,DAF-7可以激活经典的TGFβ通路,并调控远端的细胞/组织/器官中的自噬活性。我们还发现AAK-2/AMPK和STAT样蛋白STA-2在不同组织中具有不同的自噬激活作用。总之,该研究揭示了在动物发育过程中,感觉神经元感知并转导信号,进而系统性调控自噬活性的通路。
该工作由中国科学院生物物理研究所张宏课题组完成。张宏研究员为本文的通讯作者,张宏课题组博士研究生张玉洁为本文的第一作者,张宏课题组的博士毕业生祁林祥也参与了这项研究。该课题获得北京市前沿创新培育项目、中科院先导B类项目、国家自然科学基金、国家重点研发计划项目和前沿科学重点研究计划的资助。
文章链接:http://jcb.rupress.org/content/early/2019/10/25/jcb.201907196
(供稿:张宏研究组)
 附件下载:
附件下载: