2019年6月25日,《PNAS》杂志在线发表了胡俊杰课题组的研究论文“Atlastin-mediated membrane tethering is critical forcargo mobility and exit from the endoplasmic reticulum”。本研究中发现内质网膜融合蛋白atlastin(ATL)参与调节内质网中蛋白的流动性及膜转运,为管状内质网的功能阐明提供了新的依据。
真核细胞中的内质网是由连续的片状和管状结构组成的复杂网络,纵横交错的管状网络主要由两组富集于管状内质网的膜蛋白来维持:Reticulons 和REEPs可以诱导产生并稳定膜曲度,使生物膜形成管状结构;dynamin超家族蛋白 ATL则通过介导膜融合促进内质网管状网络的构建。细胞中ATL的缺失或突变会导致内质网产生长而不分枝的管状结构,ATL1的突变在人体内会引起遗传性痉挛性截瘫(HSP)。胡俊杰研究组近几年的研究成果揭示了ATL及其同源蛋白Sey1p和RHD3介导内质网同源膜融合的分子机制,而内质网管状网络在细胞生命活动中行使的具体生理功能及作用机制仍不清楚。
内质网中合成的分泌蛋白和其他内膜系统的膜蛋白在经过折叠修饰后,需要通过COPII (coat protein II) 包被的囊泡运往高尔基体。本研究发现ATL敲除的细胞中,外周COPII的形成显著减少,货物蛋白从内质网的输出被延迟。内质网输出位点(ER exit sites,ERESs)的行成和分布并不受到ATLs缺失的影响,但是很多输出位点不能进一步招募COPII衣被蛋白。半通透细胞的COPII出芽实验显示,内质网中缺失ATLs或内质网被瞬时片段化时,COPII货物蛋白的包装效率都会明显降低,而不同的货物会受到不同程度的影响。进一步研究发现ATL的缺失会降低货物蛋白在内质网中的流动性。有趣的是,不能介导融合但可以部分实现膜拴连的ATL1 R77A突变体在缺失了ATLs的细胞中表达时,虽不能完全恢复内质网的形态,却足以恢复蛋白的流动性和COPII的形成。这些发现表明,内质网膜的拴连对于调控内质网中的物质流动,以及COPII货物蛋白的有效包装起着至关重要的作用。有报道显示,膜的侧向张力对膜的流动性有很大影响,而膜拴连恰恰能起到维持膜侧向张力的效果。
该工作由中国科学院生物物理研究所及香港科技大学合作完成。生物物理研究所胡俊杰研究员和香港科技大学郭玉松教授为本文的共同通讯作者,胡俊杰课题组的牛丽灵和郭玉松课题组的马天骥为本文的并列第一作者。该研究得到国家自然科学基金,国家重点研发计划和中国科学院战略性先导科技专项(培育项目)的支持。
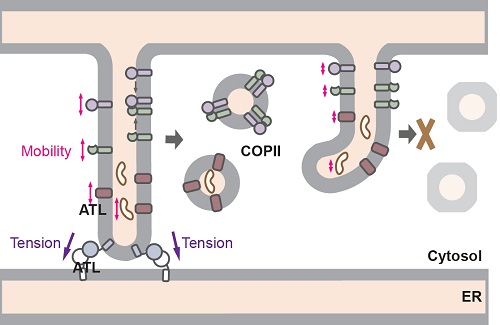
图示:ATL调节COPII形成的模式图
文章链接:https://www.pnas.org/content/early/2019/06/24/1908409116
(供稿:胡俊杰研究组)
 附件下载:
附件下载: