2018年8月23日,Nature杂志在线发表了中国科学院生物物理研究所、中国科学院动物研究所及中国科学院干细胞与再生创新研究院等单位合作完成的题为“SIRT6 deficiency results in developmental retardation in cynomolgus monkeys”的研究论文。该研究首次结合非人灵长类动物模型、人类干细胞模型及基因编辑技术揭示了调控灵长类动物发育和寿命的关键分子开关,为研究人类子宫内发育迟缓综合征提供了重要的模型体系。
衰老是机体生理功能随时间逐渐退化的过程,是神经退行性疾病、动脉粥样硬化、糖尿病和恶性肿瘤等慢性疾病的最大风险因素。衰老进程由遗传和表观遗传因素共同调控,因此理解衰老的遗传和表观遗传基础是延缓衰老和防治衰老相关疾病的重要前提。早在1999年,人们就发现Sir2基因(编码一种组蛋白去乙酰化酶)具有延长酿酒酵母寿命的作用,因此被称为“长寿基因”。在啮齿类动物中,Sir2的同源基因SIRT6也被认为参与了衰老及寿命的调控:过量表达SIRT6能够延长雄性小鼠的寿命,而敲除SIRT6则会使小鼠表现出皮下脂肪减少、脊柱弯曲和变形、骨密度降低、肠道上皮受损、端粒缩短等加速衰老的表型,且小鼠寿命缩短至约1个月。由于SIRT6在功能上链接着表观遗传稳态、基因组稳定性和代谢调控,因此SIRT6被认为是经典的“长寿蛋白”,并成为人们试图延缓衰老的重要靶标。然而,迄今为止几乎所有SIRT6作为“长寿蛋白”的证据均来源于小鼠和其他低等模式生物,而SIRT6能否在灵长类动物中发挥类似的功能尚不清楚。

图1, 利用CRISPR/Cas9基因编辑技术获得SIRT6全身敲除的食蟹猴
中国科学院生物物理研究所、中国科学院动物研究所及中国科学院干细胞与再生创新研究院等单位联合攻关,经过三年多的不懈努力,首次实现了SIRT6在非人灵长类动物中的全身敲除,获得了世界上首例长寿基因敲除的食蟹猴模型。与SIRT6敲除小鼠表现的加速衰老表型明显不同,SIRT6敲除的食蟹猴在出生数小时内即死亡。多项分析结果显示,SIRT6敲除的食蟹猴未见加速衰老表型,却表现出严重的全身发育迟缓。新生SIRT6敲除猴的脑及多种其他器官组织均表现出明显的胚胎期未成熟的细胞和分子特征。此外,利用人类干细胞模型开展的研究表明,SIRT6缺乏也可阻滞人类神经干细胞向神经元的分化。进一步的分子机制研究发现,SIRT6通过介导长链非编码核糖核酸H19印记调控区的组蛋白去乙酰化来反式抑制H19的表达,而SIRT6的缺乏则会在灵长类动物神经前体细胞中引起H19表达的异常上调,进而导致脑发育迟缓。
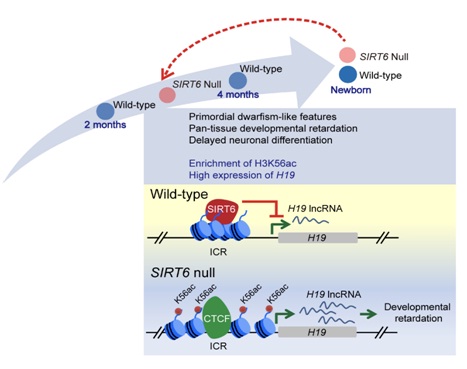
图2, SIRT6缺失导致lncRNA H19表达上调,从而延缓灵长类脑发育。
该研究首次揭示了灵长类和啮齿类动物在衰老和寿命调节通路方面的差异,为开展人类发育和衰老的机制研究以及相关疾病的治疗奠定了重要的基础。Nature杂志同期发表的题为“Role for the longevity protein SIRT6 in primate development”的NEWS AND VIEWS指出:“这些发现提示SIRT6具有调节胚胎发育的全新作用,这有别于其在衰老中的作用”;“虽然仍面临着伦理和技术上的挑战,本文作者所取得的成就,同人类胚胎研究中获得的成功相类似,都将为日后将CRISPR技术应用于人类遗传疾病的治疗带来希望。”
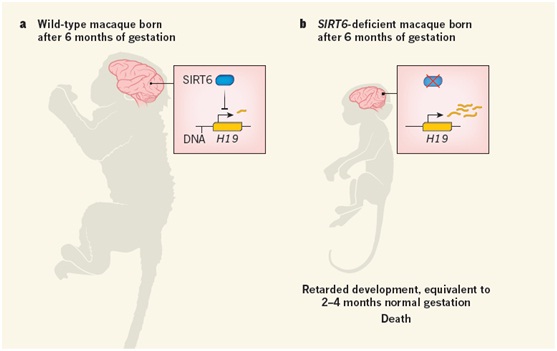
图3,SIRT6调节灵长类发育的新型作用(图摘自Nature同期NEWS AND VIEWS)。
该研究工作由中国科学院生物物理研究所、中国科学院动物研究所、中国科学院干细胞与再生创新研究院、首都医科大学宣武医院、北京大学附属第一医院和中山大学等机构合作完成。中国科学院生物物理研究所刘光慧研究员、中国科学院动物研究所李伟研究员和胡宝洋研究员为论文的共同通讯作者。中国科学院生物物理研究所张维绮研究员,中国科学院动物研究所万海峰助理研究员、冯桂海副研究员和曲静研究员为共同第一作者。周琪院士对工作的开展给予了重要的指导和支持。该研究受到中科院“器官重建与制造”战略科技先导专项、科技部和基金委等项目的资助。
文章链接:
https://www.nature.com/articles/s41586-018-0437-z
https://www.nature.com/articles/d41586-018-05970-9
(供稿:刘光慧课题组)
 附件下载:
附件下载: