2018年6月1日,《EMBO Journal》杂志在线发表了中国科学院生物物理研究所王志珍院士课题组的研究论文“Secretory kinase Fam20C tunes endoplasmic reticulum redox state via phosphorylation of Ero1a”。该研究发现分泌途径激酶Fam20C可通过磷酸化内质网巯基氧化酶Ero1a来调控内质网的氧化还原稳态,首次建立了蛋白质的磷酸化修饰与氧化折叠之间的联系;为内质网等分泌途径细胞器的环境和功能的调控提供了新的机制;揭示了蛋白质磷酸化修饰新的生物学功能。
人基因组编码的蛋白中约有30%是磷酸化蛋白。作为重要的翻译后修饰,蛋白磷酸化调节细胞生命活动的几乎所有方面。自1883年首个磷酸化蛋白酪蛋白被报道以来,有关磷酸化的研究主要集中在细胞质和细胞核中,直到2012年才发现第一个分泌途径中的蛋白激酶Fam20C,正是催化酪蛋白磷酸化的激酶。Fam20C能够催化100多种分泌到胞外的蛋白的磷酸化,其功能缺陷与骨发育不良疾病雷恩综合症密切相关。然而,Fam20C对内质网等分泌途径细胞器功能的研究几乎是空白。
王志珍院士课题组长期研究内质网中蛋白质二硫键形成及氧化还原稳态维持的机制。本研究首先通过相互作用蛋白组学方法发现Fam20C和349个定位于内质网和高尔基体的蛋白质有相互作用,蛋白质折叠通路的许多关键酶被高度富集。利用定位在内质网的氧化还原敏感的荧光蛋白探针(superfolded-roGFP-iEER)观察到Fam20C基因敲除的细胞内质网处于更加还原的状态。进一步研究发现,真核细胞内质网中负责催化二硫键形成最关键的巯基氧化酶Ero1a的145位丝氨酸可发生磷酸化修饰,并鉴定其激酶就是Fam20C。磷酸化的Ero1a在体内和体外均表现更高的氧化酶活力,这是一种与已知的调控二硫键“开关”完全不同的调节Ero1a酶活力的方式。研究人员还发现,Fam20C是在高尔基体中催化Ero1a磷酸化,磷酸化的Ero1a被分子伴侣ERp44以巯基滞留的方式返回内质网中执行功能。这也回答了为什么在内质网发挥功能的Ero1a却没有内质网滞留序列这个长期没有回答的问题。有趣的是,在低氧胁迫、还原应激以及分泌蛋白合成旺盛的哺乳期小鼠乳腺组织中,Ero1a的磷酸化水平均显著上调,从生理和整体水平上揭示了Ero1a磷酸化与内质网蛋白质氧化折叠的紧密联系。
中科院生物物理所王志珍课题组王磊副研究员为论文的通讯作者,王志珍课题组博士生张建超为论文的第一作者。北京大学肖俊宇课题组参与了该研究。生物物理所科学研究平台为该工作提供了大力支持。该研究得到了国家重点研发计划、国家自然科学基金和中科院青年创新促进会等项目的资助。
文章链接:http://emboj.embopress.org/content/early/2018/06/01/embj.201798699
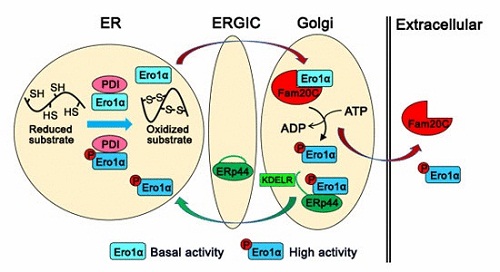
Fam20C调控内质网氧化还原稳态和蛋白质氧化折叠的示意图
(供稿:王志珍课题组)
 附件下载:
附件下载: