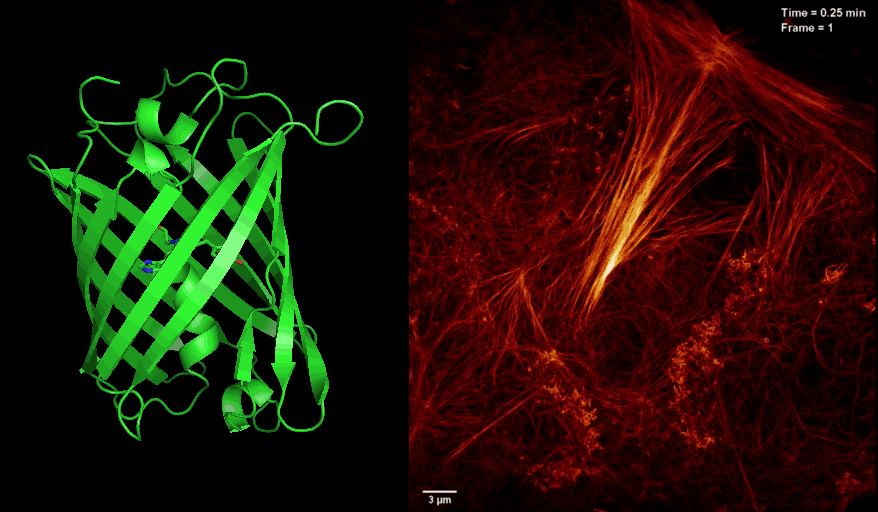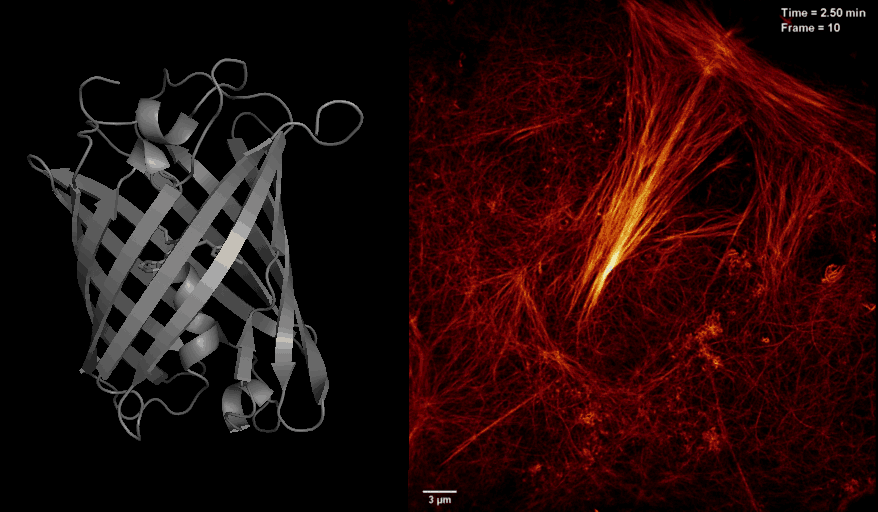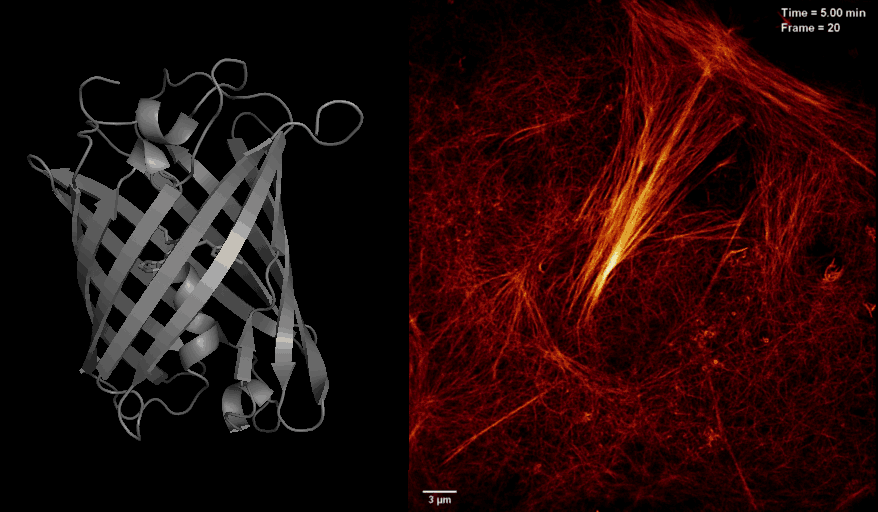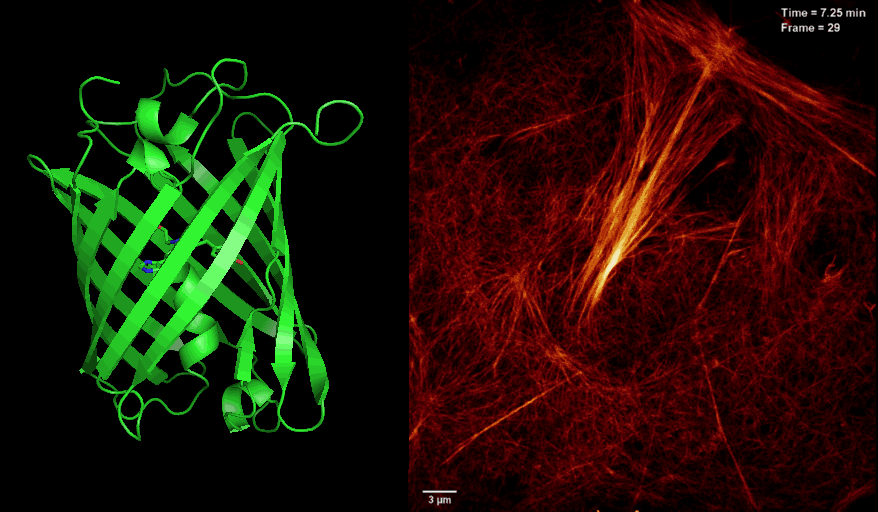
2016年8月26日,美国国家科学院院刊PNAS杂志在线发表了中科院生物物理研究所徐平勇课题组和诺贝尔奖得主HHMI 研究员Eric Betzig课题组以及李栋研究员合作的研究论文 “Highly photostable reversibly photoswitchable fluorescent protein with high contrast ratio for live cell super-resolution microscopy”,介绍了新型光开关荧光蛋白Skylan-NS的特点和其应用于活细胞超高分辨率显微成像的独特优势。
长期以来,活细胞超分辨荧光显微成像受到严峻的挑战,其中一个很重要的原因是荧光蛋白探针的缺乏。将可逆光开关荧光蛋白应用于饱和损耗的非线性超高分辨显微技术(如SD NL-SIM, RESOLFT等)很大程度降低了照射光的能量需求,是实现活细胞超分辨成像的途径之一。然而,受限于现有光开关荧光蛋白Dronpa and rsEGFP家族的固有光学性质:开关循环数少、荧光信号低、对比度差等,目前很难在活细胞超分辨成像中达到理想的分辨率。针对以上问题,徐平勇课题组于近期开发出一种新型单体光开光荧光蛋白Skylan-NS,并和诺贝尔奖得主HHIM 研究员Eric Betzig合作,将其应用于新发展的条纹光激活非线性结构光照明超分辨成像技术(patterned activation NL-SIM, PA NL-SIM)(Science,2015),首次在活细胞内同时实现了低能量(~100 W/cm2)、高采样速度(亚秒级别)、高分辨率(~60 nm)、长时间(30个时间点)、大视野的超分辨成像。由于Skylan-NS在光稳定性、开光循环数以及信噪比等方面的绝对优势,使其成为目前适用于该活细胞超高分辨显微成像技术的最佳荧光蛋白探针。
新型荧光蛋白的开发往往是新成像技术实现的前提和助推器。发展新型荧光蛋白并用于超高分辨显微成像研究是中科院生物物理所徐平勇课题组的重要研究方向。 徐平勇研究员、Eric Betzig研究员为本文的通讯作者;张茜博士、张名姝副研究员和李栋研究员为共同第一作者。该工作受到国家“973”计划 、国家自然科学基金、北京市自然科学基金、中科院基金先导项目等的资助。
(供稿:徐平勇课题组)
 附件下载:
附件下载: