中科院生物物理研究所龚为民组、娄继忠组对结节性硬化症的研究取得重要进展,该成果于2013年7年16日在线发表在《Nature Communications》杂志上,题为“Crystal structure of the yeast TSC1 core domain and implications for tuberous sclerosis pathological mutations”。
结节性硬化症(Tuberous Sclerosis Complex, TSC)是一种常染色体主导的多系统疾病,以良性肿瘤的发生为标志,通常影响大脑、肾脏、皮肤、心脏和肺等器官,常常造成神经性疾病,包括癫痫、智障和自闭症。该疾病的发生主要由编码TSC1和TSC2蛋白的基因突变导致,TSC1 和TSC2蛋白能形成复合物控制下游的TOR信号通路从而调控细胞生长。
发表在《Nature Communications》上的工作主要对TSC1上的点突变诱发结节性硬化症的分子机制做了深入研究。酵母TSC1能被蛋白酶降解出稳定的N端结构域,该结构域被实验和生物信息学两方面的证据佐证,被命名为核心结构域。该核心结构域在溶液中以二聚体的形式存在,但存在高聚体化的倾向,晶体中可形成十聚的五元环结构。令人惊讶的是,与酵母TSC1核心结构域对应的人源TSC1部分包含了几乎所有已知致病性点突变。该项研究解析了酵母TSC1核心结构域的晶体结构并用其模拟了对应的人源TSC1的结构,结合已知点突变的致病性信息,揭示了几乎所有致病性TSC1突变都是由于突变破坏了蛋白N端结构域的折叠。这些发现对针对结节性硬化症的药物设计具有重要的指导意义。
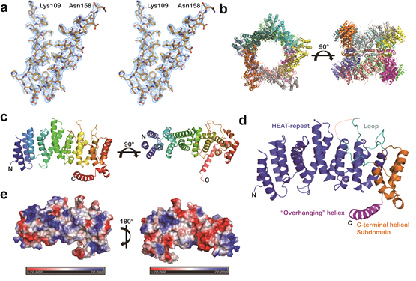
图 酵母TSC1核心结构域的结构示意图
本项工作获得了科技部973项目的支持。
文章链接:http://www.nature.com/ncomms/2013/130716/ncomms3135/full/ncomms3135.html
(供稿:龚为民课题组)
 附件下载:
附件下载: