2013年5月23日,国际知名杂志《Cell Research》刊发了中国科学院生物物理研究所王大成课题组与毕利军课题组合作完成的题为“Crystal structure of L,D-transpeptidase LdtMt2 in complex with meropenem reveals the mechanism of carbapenem against Mycobacterium tuberculosis”的研究工作,该研究报道了结核分枝杆菌L,D转肽酶,LdtMt2及其与meropenem(beta-内酰胺抗生素,碳青霉烯类)形成的加合物的晶体结构,提出了meropenem-clavulanate(后者为结核分枝杆菌beta-内酰胺抗生素水解酶Blac的抑制剂)联用可以有效抑制结核分枝杆菌的分子机理,作为一个潜在的新药物靶点,为结核病,特别是多耐药结核与泛耐药结核的临床治疗与新型抗结核药物的研发提供了可靠的理论指导。
结核病目前仍是困扰人类的一个顽疾,由于各类抗生素的滥用,治疗的不彻底性以及与艾滋病毒共感染从而导致大量耐药菌的出现,给我们治疗结核病提出了严峻的挑战,新药的发现已是迫在眉睫。β内酰胺类抗生素(如青霉素)早已被广泛用于治疗各种细菌感染,其作用机理是通过抑制细菌D,D-转肽酶的4-3交联活性,从而干扰细胞壁的合成。但是这些抗生素对于结核杆菌则收效甚微,因为结核杆菌编码自身一种β内酰胺酶BlaC,它可以水解各种β内酰胺类抗生素。唯一例外的是碳青霉烯类抗生素(如meropenem),BlaC对它的水解效率极差。2009年,Blanchard小组解析了BlaC和meropenem复合物的结构,并且证明联合使用meropenem-clavulanate可以有效对抗休眠期(或非复制期)的泛药抗性结核杆菌。
研究发现,结核杆菌在转向休眠期时,其细胞壁肽聚糖交联形式发生重建,主要由4-3交联变为3-3交联。Lamichhane小组发现LdtMt2蛋白在3-3交联形成过程中起关键作用,缺失LdtMt2会导致结核杆菌的菌落形态发生改变,同时失去毒性。LdtMt2是一种 L,D-转肽酶,这类转肽酶对一般的β内酰胺类抗生素不敏感,但是碳青霉烯类抗生素(包括meropenem)却可以有效抑制其活性。为此我们从结构生物学的角度阐明了二者的相互作用方式,并提出了作用机理。
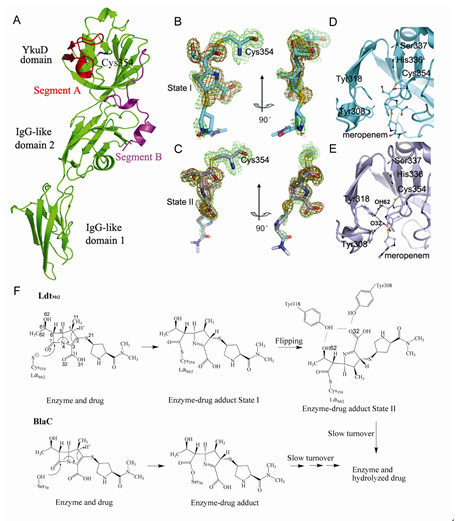
图1: LdtMt2蛋白质晶体结构、meropenem结合状态以及推测的meropenem抑制LdtMt2和BlaC内酰胺酶的反应机理。
该项研究工作,LdtMt2的晶体生长和相关生化实验是由毕利军课题组的李文娟博士完成,结构解析由王大成课题组李德峰副研究员完成。
以上工作得到了国家重大基础研究计划,国家自然科学基金委的资助。
文章链接:http://www.nature.com/cr/journal/v23/n5/full/cr201353a.html
(供稿:王大成课题组、毕利军课题组)
 附件下载:
附件下载: