2009年北京时间2月5日,著名期刊《自然》(Nature)再次在线发表了中国科学院生物物理研究所刘迎芳研究员领导的实验室和饶子和院士领导的南开大学/清华大学/生物物理所联合实验室在禽流感病毒RNA聚合酶研究上再次取得的最新合作研究成果,论文题为"Crystal structure of an avian influenza polymerase PAN reveals an endonuclease active site",《自然》杂志为此专门配发了新闻。
流感病毒是含有8个RNA基因组片段的负链RNA病毒,已知可以编码11种病毒蛋白质。其中,PB1,PB2和PA等3个蛋白质亚基组成流感病毒重要的生命机器:流感病毒RNA聚合酶。
在禽流感病毒的复制和感染的过程中,流感病毒聚合酶发挥至关重要的作用,它负责行使病毒基因组RNA的复制以及病毒mRNA转录等多方面功能。PB2蛋白负责捕捉宿主细胞的mRNA分子用于自身mRNA转录,PB1含有聚合酶活性中心,是行使病毒RNA的合成功能的催化亚基,而PA在该复合体的功能一直没有明确。
研究流感病毒聚合酶的结构不仅仅对揭示流感病毒聚合酶的作用机制具有重要的科学意义,还将对临床上抗病毒药物的研发提供清晰的分子模型。这是有力抗对病毒感染的重大发现。研究这一复合体是一个重大挑战,目前需要尽快解决这一复合体或者其组成的亚基的结构。
2008年8月28日《Nature》杂志曾发表了刘迎芳研究员实验室和饶子和院士实验室合作完成的禽流感病毒 H5N1毒株RNA聚合酶复合体PA亚基的羧基端(PAC)与PB1氨基端短肽(PB1N)复合体的三维结构(Crystal structure of the polymerase PAC–PB1Ncomplex from an avian influenza H5N1 virus),这一结构揭示了PA与PB1亚基相互作用的方式以及PA在结合核苷酸等方面的机制,为进一步开展相关研究提供了结构信息。但是,由于这一结构仅包含PA蛋白的一部分,这一结构的研究也存在着明显的不足,即:它未能确切的揭示PA在参与转录功能的分子机制。在后续的研究工作中,他们进而又解析了PA剩余的含有约256氨基酸残基的PA氨基端精细三维晶体结构。通过对该结构的分析,他们发现该蛋白有可能是一个具有新型结构的核酸内切酶。据此,他们进一步开展了一系列的体内和体外的分子生物学、生物化学实验分析,其结果充分证实了他们根据结构分析所作出的这一推测。该内切核酸酶活性将使聚合酶复合体捕获的宿主细胞mRNA被流感病毒聚合酶内切酶切割,以用于病毒mRNA转录。这一活性的缺失,将造成病毒不能在细胞内转录mRNA。这一结论首次清晰揭示了PA参与病毒转录功能的一个重要分子机制,同时还首次证明了禽流感病毒RNA聚合酶中所具有的核酸内切酶功能是在PA亚基上,而很可能不是在以往人们报导的PB1亚基上。这一研究结果不仅揭示了PA的功能机制,而且还为相关药物的研究和开发提供了一个新的原子水平的精细结构平台。
该项工作研究期间,英国牛津大学的Ervin Fodor博士及Tao Deng博士、新加坡国立大学Ruowen Ge博士等亦参与了部分研究工作,美国的APS同步辐射中心的张荣光教授在数据收集中提供了帮助。中国农科院陈化兰研究员和于康震研究员提供了病毒基因。该研究课题得到了国家自然科学基金委员会、科技部和中国科学院的扶持和资助。
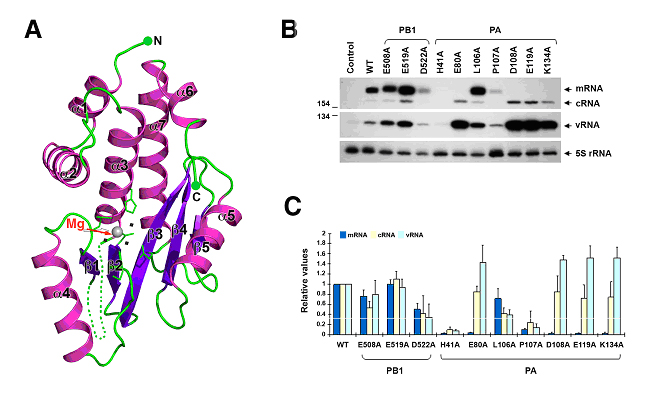
图片说明:禽流感病毒RNA聚合酶亚基PA氨基端结构与功能分析。(A)PA氨基端结构飘带图。其中镁离子(银色小球)以红字(Mg)标出;三个小黑点代表水分子。(B)与(C)PA亚基内切核酸酶活性鉴定及数据统计分析。
(综合处报道)
(2009年2月5日)
 附件下载:
附件下载: