为什么我们会感觉白天精力充沛,夜晚却容易困倦?这种现象不仅仅与睡眠有关,实际上是"能量工厂"线粒体和"内部时钟"昼夜节律的默契配合在发挥作用。就像舞台上的两位舞者,一个负责提供动力,一个负责掌控节奏,只有配合得当,我们的身体才能在每天24小时内运转自如。让我们来一探线粒体与昼夜节律之间的奇妙关系,看看它们是如何共同维持我们的健康和活力的。
线粒体和昼夜节律表面上似乎属于两个完全不同的系统:线粒体专注于能量代谢,而昼夜节律则是调控时间生物钟。然而,它们实际上在调控生理过程时存在密切的协同作用。
线粒体-细胞的能量工厂
线粒体是细胞中的双层膜细胞器,细胞呼吸的核心目的是通过分解有机分子(如葡萄糖)释放能量并生成三磷酸腺苷(ATP),为细胞的生理活动提供能量,而其中的两个重要步骤:柠檬酸循环和氧化磷酸化都需要在线粒体中进行。线粒体中发生的一系列高度协调的生化反应,将有机分子中的化学能转化为ATP,这个过程不仅高效,而且能够根据细胞的能量需求进行调节,确保细胞在各种生理条件下都能获得足够的能量,支持其功能和生存。因此线粒体也被称为细胞的"能量工厂"[1]。
细胞中的线粒体(www.freepik.com)
昼夜节律-身体的时间管家
昼夜节律是指生物体为适应明-暗环境变化而进化出的一种以24 小时为周期的内源性节律。昼夜节律受到机体内部生物钟的调控,下丘脑视交叉上核(SCN)是生物钟的起搏器,在接收光信号刺激后可通过神经和内分泌系统对外周生物钟进行同步化调节[2]。机体的多个生理过程,包括睡眠觉醒周期、激素分泌、体温变化等都具有昼夜节律性,它帮助机体的节律与外界环境相适应,并及时对环境改变做出预见性应答,从而保证整体功能正常运作。

昼夜节律与线粒体的密切关系
精准匹配能量需求时机:线粒体会根据人体活动水平来调节能量生产。在白天,人体需要更多的能量来支持活动,线粒体的功能会增强,产生更多的ATP以供细胞使用。晚上,当身体进入休息状态时,线粒体的能量生产需求下降,活动也会相应减少。这种密切配合,能帮助人体在不同时段以最佳状态运行[3]。
调节线粒体生理过程:昼夜节律影响着线粒体生物合成、动力学、形态变化等多个生理过程。参与线粒体生物合成的因子,如PGC-1α、线粒体氧化还原蛋白等[4],表达都被发现具有昼夜节律性振荡。在细胞活动旺盛的白天,线粒体往往会呈现较多的分裂,产生更多的单体以适应更高的能量需求。相反,夜晚时分,线粒体更倾向于融合,形成更大的结构来储存能量并进行修复[5]。另外,线粒体形态也在一天当中呈现出周期性变化[6]。
线粒体对昼夜节律的反馈调节:昼夜节律的稳定输出线粒体功能的正常运转具有重要联系。线粒体功能失调可能导致氧化应激的增加。这种情况下,产生过量的活性氧类(ROS)不仅损伤细胞,还可能干扰昼夜节律。线粒体通过生成能量代谢副产物(如ATP、NADH、ROS等)反馈到细胞核,调控昼夜节律基因的表达。例如,ATP的水平可以调节与昼夜节律相关的核心蛋白(如PER和BMAL1)的稳定性,进而影响昼夜节律的精准运行。
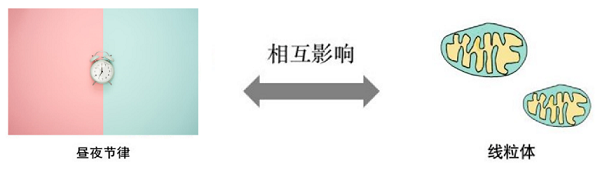
线粒体-昼夜节律失调与疾病
代谢综合征:不规律的睡眠和饮食模式会干扰昼夜节律,影响线粒体对脂肪和糖的代谢效率,增加胰岛素抵抗风险,进而导致肥胖和糖尿病等代谢类疾病[7]。
神经退行性疾病:线粒体产生的氧化应激和昼夜节律失调与神经退行性疾病的发生发展密切相关。一个皮层神经元在静息状态下每秒需消耗47亿个ATP分子[8]。在阿尔茨海默病患者体内观察到线粒体形态和功能都发生了一定的变化,帕金森病患者线粒体中复合体酶I活性降低,破坏了黑质神经元的完整性[9]。昼夜节律紊乱也被认为是这些引发这些疾病的重要因素之一,处于昼夜节律紊乱环境中的小鼠下丘脑中多个时钟基因的转录水平异常,出现焦躁、过度活跃及日间睡眠片段化,从而加速了神经细胞的损伤[10]。
心血管疾病:线粒体作为细胞代谢产生ATP的关键场所,为人类心肌细胞的收缩和舒张提供了大量能量。功能异常的线粒体积累会引发心血管疾病。例如,在心力衰竭中,心脏对能量的需求特别高,需要依赖线粒体的氧化磷酸化(OXPHOS)来持续为心肌细胞提供ATP[11]。健康人的血压和心率在白天较高,夜间较低,这种变化与昼夜节律同步,不规律的睡眠或睡眠不足会扰乱昼夜节律,并增加高血压、动脉粥样硬化、心衰等心血管疾病的发病率[12]。
小节与展望
总的来说,线粒体与昼夜节律的关系反映了生物体内能量代谢与时间节律的密切协作。昼夜节律帮助线粒体精准匹配机体每日能量需求,调节了包括线粒体生物合成、线粒体动力学以及形态变化等多个生理过程。同时,线粒体也能对昼夜节律产生反馈调节,如线粒体可通过多种能量代谢副产物调控昼夜节律基因的表达,线粒体功能失调则会对会对昼夜节律产生不良影响。因此,两者之间的双向调节确保了身体在不同时间段都能有效维持能量平衡和健康状态。
理解线粒体与昼夜节律之间的互动机制,对于预防和治疗相关疾病有重要的临床意义。在日常生活中,我们可以通过规律作息、均衡饮食、适当运动保护线粒体健康及维持昼夜节律的稳定。(详情请点击阅读原文)
参考文献
[1] van der Bliek A M,Sedensky M M,Morgan P G. Cell biology of the mitochondrion. Genetics,2017,207 (3):843-871
[2] Hastings M H,Maywood E S,Brancaccio M. Generation of circadian rhythms in the suprachiasmatic nucleus. Nat Rev Neurosci,2018,19(8):453-469
[3] Neufeld-Cohen A,Robles M S,Aviram R,et al. Circadian control of oscillations in mitochondrial rate-limiting enzymes and nutrient utilization by PERIOD proteins. Proc Natl Acad Sci USA,2016,113(12):E1673-E1682
[4] Richardson R B,Mailloux R J. Mitochondria need their sleep: redox,bioenergetics,and temperature regulation of circadian rhythms and the role of cysteine-mediated redox signaling,uncoupling proteins,and substrate cycles. Antioxidants (Basel),2023,12(3):674
[5] Jin Z,Ji Y,Su W,et al. The role of circadian clock-controlled mitochondrial dynamics in diabetic cardiomyopathy. Front Immunol,2023,14: 1142512
[6] Schmitt K,Grimm A,Dallmann R,et al. Circadian control of DRP1 activity regulates mitochondrial dynamics and bioenergetics. Cell Metab,2018,27(3):657-666.e5
[7] Lee D Y,Jung I,Park S Y,et al. Attention to innate circadian rhythm and the impact of its disruption on diabetes. Diabetes Metab J,2024,48(1):37-52
[8] Kramer P,Bressan P. Our (mother's) mitochondria and our mind. Perspect Psychol Sci,2018,13(1):88-100
[9] Moon H E,Paek S H. Mitochondrial dysfunction in Parkinson's disease. Exp Neurobiol,2015,24(2):103-116
[10] 卢悦,赵国杰,吴芳杉,等. γ-氨基丁酸对昼夜节律紊乱型小鼠睡眠干预研究. 营养学报,2023,45(2):139-147
[11] Liu Y,Huang Y,Xu C,et al. Mitochondrial dysfunction and therapeutic perspectives in cardiovascular diseases. Int J Mol Sci,2022,23(24):16053
[12] Neves A R,Albuquerque T,Quintela T,et al. Circadian rhythm and disease: Relationship,new insights,and future perspectives. J Cell Physiol,2022,237(8):3239-3256
作者简介
杨婷婷:北京体育大学研究生,研究方向为昼夜节律与骨骼肌健康。
于 亮:北京体育大学教授,博士生导师,研究方向为运动表现生理学与体能训练、运动与骨骼肌。
(作者:杨婷婷、于亮)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: