过敏性疾病已成为21世纪重点研究和防治的疾病。过敏性疾病是由于机体对过敏原产生异常免疫反应引起的一大类疾病,当机体再次受到相同抗原刺激时会出现组织损伤或功能紊乱的异常免疫反应。引发过敏反应的因素有很多,包括食物、吸入物(如花粉等)、微生物(如霉菌等)、昆虫毒素、药物(如青霉素等)、异种血清和物理因素等。过敏虽然难以根治,但可防可控,了解过敏原有助于我们有效预防过敏。
引起过敏反应的物质称为过敏原,大家普遍认为过敏原主要是蛋白质,而忽略了一类广泛存在的过敏原--蛋白质上的糖链。临床上常见部分患者的过敏反应不是针对同一种成分,而是对一系列不同成分过敏,这种现象称为交叉反应,而引起交叉反应的物质称为交叉反应糖链决定簇(cross-reactive carbohydrate determinant,CCD)[1-2],常见于植物和昆虫的细胞表面。
蛋白质糖链修饰是通过糖基化过程完成的,常见有N-糖基化和O-糖基化。N-糖基化(N-glycosylation)是N-乙酰葡糖胺与蛋白质上天冬酰胺残基的NH2在内质网进行连接[3],生成N-糖蛋白;O-糖基化(O-glycosylation)是半乳糖或N-乙酰半乳糖胺与蛋白质上丝氨酸、苏氨酸和羟脯氨酸的OH在高尔基体进行连接[3],合成O-糖蛋白。其中,对N-糖蛋白与过敏的研究较多。
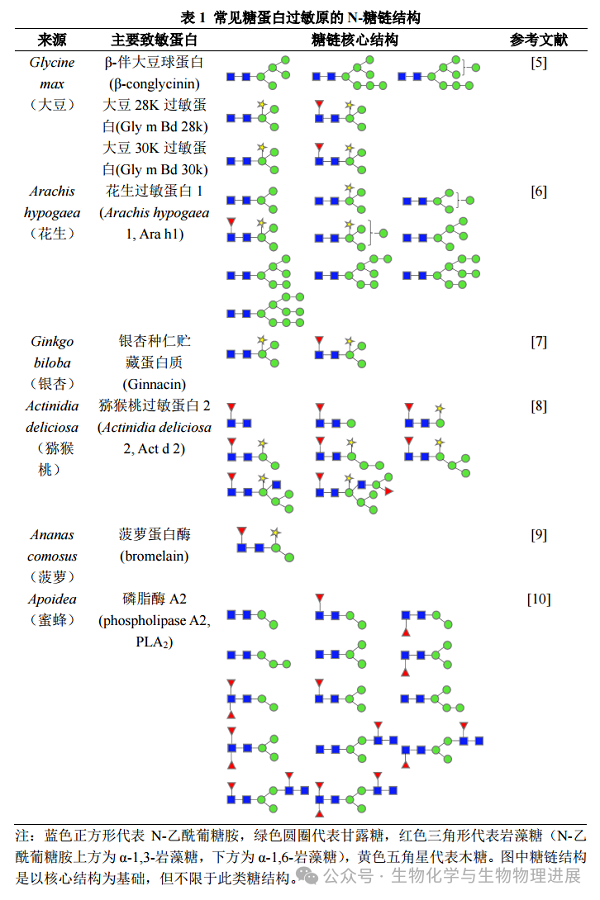
常见的含糖链过敏原有哪些?植物糖蛋白过敏原(如花生Ara h 1蛋白、大豆β伴大豆球蛋白等)N-糖链上普遍存在含有β-l,2-木糖和核心α-l,3-岩藻糖结构的N-糖链。昆虫来源糖蛋白过敏原(如蜜蜂蜂毒PLA2等)N-糖链中存在核心α-l,3-岩藻糖和核心α-l,6-岩藻糖结构。有研究认为,这些植物和昆虫的N-糖蛋白普遍含有的糖链结构是导致过敏反应的可能原因[4]。部分过敏原N-糖链结构见表1。
去除糖蛋白过敏原上糖链会降低过敏反应。例如,通过PNGase F对花生主要过敏原Ara h 1蛋白去N-糖基化,1名花生过敏患者血清IgE与Ara h 1的结合降低[11];利用PNGase F去糖基化可降低大豆7S球蛋白与IgE的结合能力,即通过酶法去糖基化可减少大豆7S球蛋白潜在的致敏性[12];通过核心岩藻糖苷酶 I(core fucosidase I,cFase I)将蜂毒PLA2去糖基化后过敏原与IgE反应性降低[13];利用α-1,3甘露糖苷酶(α-1,3-mannosidase,MA3)处理蜂毒PLA2后发现,过敏原与IgE结合降低[14]。
在糖蛋白过敏原上再增加糖修饰,也可能降低过敏。例如,通过谷氨酰胺转移酶(transglutaminase,TGase)将牛奶β乳球蛋白、虾原肌球蛋白表面增加乙酰葡糖胺,发现糖基化后的过敏原抗原性和潜在致敏性均降低[15-16]。
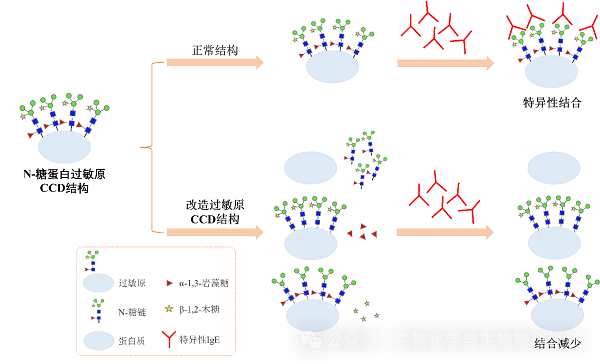
糖苷酶改变过敏原的糖结构从而降低过敏反应示意图
总的来讲,过敏原多种多样,除了主要成分蛋白质外,我们还要关注过敏原上的其他修饰成分,这些成分也可能参与过敏反应。过敏原蛋白上的糖链修饰,让我们对过敏原有了新的认识。(详情请点击阅读原文)
目前,过敏尚无特异性治疗方法,常用的防治方法是避免接触过敏原、对症治疗或脱敏治疗。通过去除或改变糖蛋白类过敏原的糖结构,或许从而自源头解决部分糖蛋白引起的过敏问题,为临床过敏性疾病的预防或实现长期持续疗效的治疗提供新的方向。
参考文献
[1] Mari A. IgE to cross-reactive carbohydrate determinants: analysis of the distribution and appraisal of the in vivoand in vitro reactivity. Int Arch Allergy Immunol,2002,129(4):286-295
[2] Foetisch K,Westphal S,Lauer I,et al. Biological activity of IgE specific for cross-reactive carbohydrate determinants. J Allergy Clin Immunol,2003,111(4):889-896
[3] Kurebayashi Y,Takeuchi H. Special issue: new insights into protein glycosylation. Molecules,2023,28(7):3263
[4] Wilson I B H. Glycosylation of proteins in plants and invertebrates. Curr Opin Struct Biol,2002,12(5):569-577
[5] 李玲梅. 大豆糖蛋白N-糖基化分析及其致敏性研究.西安:西北大学,2017
[6] 彭艺芳. 花生致敏糖蛋白Ara h1糖链决定簇的质谱分析.西安:西北大学,2016
[7] 李成. 银杏种子糖蛋白N-糖链分析及其致敏性研究.西安:西北大学,2019
[8] Garrido-Arandia M,Murua-García A,Palacin A,et al. The role of N-glycosylation in kiwi allergy. Food Sci Nutr,2014,2(3):260-271
[9] Van Kuik J A,Hoffmann R A,Mutsaers J M,et al. A 500-MHz1H-NMR study on theN-linked carbohydrate chain of bromelain. Glycoconjugate J,1986,3(1):27-34
[10] Kubelka V,Altmann F,Staudacher E,et al. Primary structures of the N-linked carbohydrate chains from honeybee venom phospholipase A2. Eur J Biochem,1993,213(3):1193-1204
[11] Md A,Maeda M,Matsui T,et al. Purification and molecular characterization of a truncated-type Ara h 1,a major peanut allergen: oligomer structure,antigenicity,and glycoform. Glycoconj J,2021,38(1):67-76
[12] Yang A,Deng H,Zu Q,et al. Structure characterization and IgE-binding of soybean 7S globulin after enzymatic deglycosylation. Int J Food Prop,2018,21(1):171-182
[13] Li T,Li M,Hou L,et al. Identification and characterization of a core fucosidase from the bacterium Elizabethkingia meningoseptica. J Biol Chem,2018,293(4):1243-1258
[14] Shen D,Lu X,Li W,et al. Identification and characterization of an α-1,3 mannosidase from Elizabethkingia meningoseptica and its potential attenuation impact on allergy associated with cross-reactive carbohydrate determinant. Biochem Biophys Res Commun,2023,672: 17-26
[15] Yuan F,Lv L,Li Z,et al. Effect of transglutaminase-catalyzed glycosylation on the allergenicity and conformational structure of shrimp (Metapenaeus ensis) tropomyosin. Food Chem,2017,219: 215-222
[16] Yuan F,Ahmed I,Lv L,et al. Impacts of glycation and transglutaminase-catalyzed glycosylation with glucosamine on the conformational structure and allergenicity of bovine β-lactoglobulin. Food Funct,2018,9(7):3944-3955
作者简介
孙桂芹:浙江中医药大学副教授。研究方向:细菌糖苷酶功能研究、人N-糖苷酶NGLY1介导的先天性去糖基化障碍疾病(NGLY1-CDDG)。
张瑜芯:浙江中医药大学硕士研究生。研究方向:细菌N-糖苷酶PNGase F-Ⅱ功能研究。
林谦阁:浙江中医药大学硕士研究生。研究方向:脑膜炎败血伊丽莎白菌天冬氨酰氨基葡萄糖苷酶的功能研究。
陈 力:复旦大学基础医学院特聘教授。研究方向:糖链信号在宿主与病原体互作中的基础和转化医学。
(作者:孙桂芹、张瑜芯、林谦阁、陈力)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: