簇状规则间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR),是日本研究人员于1987年在K19大肠杆菌(E.coli)的碱性磷酸酶基因附近找到的串联重复序列间隔序列,后来又发现它在细菌等原核生物中广泛存在[1],2002年才被正式命名为CRISPR。CRISPR起源于细菌和古细菌的适应性免疫系统,是原核生物现如今已发展出的一种适应性免疫系统,用以对抗质粒、噬菌体等外来移动遗传因子(mobile genetic element, MGE)的攻击,被称作是一种"基因武器"。而细菌利用CRISPR系统阻止噬菌体的入侵这一现象则是在2007年被发现的。从认识到CRISPR系统是细菌的天然免疫系统以来,科学界对CRISPR系统的研究日益增加。
CRISPR系统主要由CRISPR簇(相似长度的重复序列加上间隔序列)、前导序列L和CRISPR相关的Cas蛋白(CRISPR-Cas)组成。CRISPR重复序列与Cas蛋白密切相关,Cas蛋白在细菌和古细菌中构成适应性免疫系统,用来保护它们免受外来MGE的影响。在细菌免疫系统中,CRISPR-Cas免疫主要由适应、表达、干扰三个阶段组成。第一个阶段(适应阶段)CRISPR系统将入侵病毒等外来DNA片段或质粒作为间隔物插入CRISPR簇中,与人类免疫系统中的记忆细胞类似;第二个阶段(表达阶段)CRISPR簇被转录成前体RNA,经过加工后成为成熟的CRISPR RNA(crRNA),类似于人类免疫系统的B细胞产生的特异性抗体;第三个阶段(干扰阶段)crRNA引导Cas蛋白形成更大的核糖核蛋白复合物,特异性靶向并切割同源病毒或是质粒的核酸。这类似于人体两次感染同一病原体,在两种情况下都导致抗原-抗体结合。
CRISPR-Cas系统共分为两个大类,再往下又可细分为六种类型(Ⅰ类~Ⅵ类)和33个亚型[2]。其中1类系统(Ⅰ型、Ⅲ型、Ⅳ型)在其CRISPR核糖核蛋白效应物核酸酶中使用多个Cas蛋白,而2类系统(Ⅱ型、Ⅴ型、Ⅵ型)使用单个Cas蛋白。1类CRISPR-Cas系统在细菌和古细菌当中最为常见,所占比例在所有已鉴定CRISPR-Cas基因座中高达90%。2类CRISPR-Cas系统包括剩余的10%几乎只存在于细菌中,并组装成一个核糖-核蛋白复合物,由crRNA与Cas蛋白组成,crRNA包含靶向特定DNA序列的信息。
目前所流行的Cas9与Cas12a系统均属于2类,CRISPR-Cas12a为一种由crRNA所引导的内切酶,是一种RNA引导的系统,被归类为Ⅴ型。CRISPR-Cas12a系统在病原体检测中的应用包括两个阶段:1.检测样本的核酸扩增和构建; 2.反应和CRISPR系统的演示。采用PCR、等温扩增等低成本技术扩增核酸分子,而CRISPR系统的指数扩增、快速识别和裂解提高了检测效率。CRISPR-Cas12a系统的显示部分可用荧光信号、LFA条带、芯片等,使检测结果更容易理解甚至可视化,并且还能够进行多重检测以提高检测效率。将不同类型crRNA与Cas酶结合,使用同一系统可同时检测多个靶点[3]。CRISPR-Cas12a系统的免疫流程如下图所示。
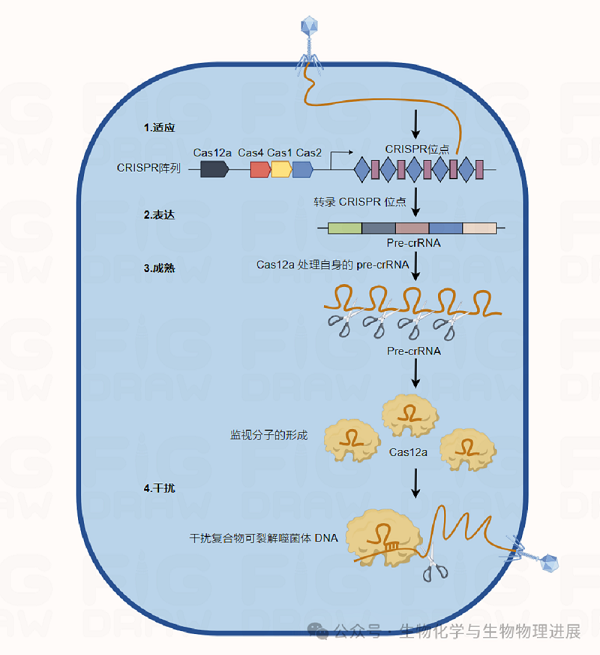
图1 CRISPR/Cas12a系统免疫流程
用于基因组操作的CRISPR-Cas技术的出现和快速发展对生命科学来说是革命性的。随着CRISPR-Cas工具包的不断应用,在生物传感器领域出现了新的亮点,这对于检测领域来说既是机遇又是挑战。在CRISPR-Cas12系列中,CRISPR-Cas12a的使用次数最多,CRISPR-Cas12a的检测法已逐步推广,随着功能核酸和细菌变构转录因子的出现,使得CRISPR-Cas12a能够应用于检测各种靶标。将CRISPR-Cas12a与LAMP、RPA等各种等温扩增(IA)技术相结合的检测法可以实现对核酸的超灵敏检测,并且具有价格合理、携带方便、快速等优势,非常适合在现场使用。如运用CRISPR-Cas12a技术所研发的核酸试纸条已实现布鲁氏菌感染菌株中野毒株和S2疫苗株的鉴别诊断,可用于布鲁氏菌感染菌株现场筛查,准确捕杀真正感染布鲁氏菌的动物(图2)。此外在表1中还列举出了另外几种运用CRISPR-Cas12a技术研发出的新型检测技术。

图2 CRISPR-Cas12a试纸条显色鉴别试剂盒("N"代表阴性)
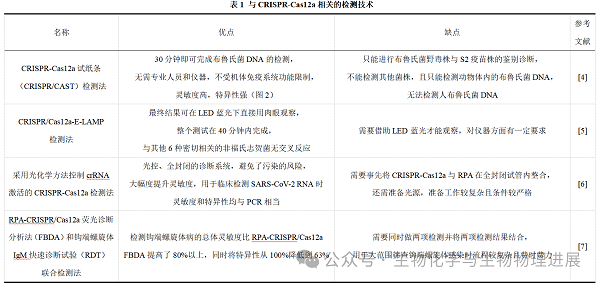
CRISPR-Cas12a技术在检测方面具有一定突出优势,但CRISPR-Cas12a检测法在推广的同时也不可避免地存在着一些技术障碍方面的缺陷。目前扩增及检测被应用到多种病原体检测策略中,将扩增子转移到检测平台是一个必要步骤,不过在此过程中易产生气溶胶及造成其他类型的污染。由于在实际应用中遇到的食品、动物和病理样品组成复杂,需要检测的核酸浓度可能较低,因此样品预处理这一环节至关重要[8]。除此之外对检测所需的仪器、设备、环境等方面的要求也同样不容忽视,需依据实际情况来决定是否可行并选择最佳方案。
CRISPR-Cas12a是CRISPR-Cas12家族中使用最频繁的一种,由于顺势疗法和反切割特性,它为生物传感器设计提供了多种选择。由于受体可用性和实用性的限制,基于CRISPR-Cas12a的生物传感器的特异性和灵敏度还有待进一步提高。此外新开发的基于CRISPR-Cas12a的应用和方法推动了众多诊断和检测解决方案的发展,CRISPR/Cas12a与其他IA技术相结合的检测结果表明,CRISPR/Cas12a联合IA技术的检测法在开发下一代核酸检测生物传感器、医疗诊断、环境监测等方面具有巨大的潜力。总之,CRISPR-Cas12a技术彻底改变了对细菌的研究。我们预计新的CRISPR技术的发现将会进一步增强我们对生命的理解,以及对生物体进行基因改造的能力。(详情请点击阅读原文)
参考文献
[1] Ishino Y, Shinagawa H, Makino K, et al. Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product. J Bacteriol, 1987, 169(12): 5429-5433
[2] Makarova K S, Wolf Y I, Iranzo J, et al. Evolutionary classification of CRISPR-Cas systems: a burst of class 2 and derived variants. Nat Rev Microbiol, 2020, 18(2): 67-83
[3] Gootenberg J S, Abudayyeh O O, Kellner M J, et al. Multiplexed and portable nucleic acid detection platform with Cas13, Cas12a, and Csm6. Science, 2018, 360(6387): 439-444
[4] Dang S, Sui H, Zhang S, et al. CRISPR-Cas12a test strip (CRISPR/CAST) package: in situ detection of Brucella from infected livestock. BMC Vet Res, 2023, 19(1): 202
[5] Shi Y, Kang L, Mu R, et al. CRISPR/Cas12a-Enhanced Loop-Mediated Isothermal Amplification for the Visual Detection of Shigella flexneri. Front Bioeng Biotechnol, 2022, 10: 845688
[6] Hu M, Qiu Z, Bi Z, et al. Photocontrolled crRNA activation enables robust CRISPR-Cas12a diagnostics. Proc Natl Acad Sci USA, 2022, 119(26): e2202034119
[7] Jirawannaporn S, Limothai U, Tachaboon S, et al. The combination of RPA-CRISPR/Cas12a and Leptospira IgM RDT enhances the early detection of leptospirosis. PLoS Negl Trop Dis, 2023, 17(8): e0011596
[8] Xiao Y, Ren H, Hu P, et al. Ultra-sensitive and rapid detection of pathogenic Yersinia enterocolitica based on the CRISPR/Cas12a nucleic acid identification platform. Foods, 2022, 11(14): 2160
作者简介
杨元超:内蒙古民族大学医学院硕士研究生,研究方向为抗感染免疫。
翟景波:内蒙古民族大学医学院教授,研究领域为人兽共患病防控关键技术研究。
(作者:杨元超、翟景波)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: