生物分子相分离,一个虽然听起来专业而遥远的概念,实际上在我们身体内的每一个细胞中都上演精彩的"魔术"。它指的是在没有膜包裹的情况下,生物分子如蛋白质、核酸自发地聚集形成液滴状结构的过程。这种现象不仅在基础科学领域引起了广泛关注,也对理解生命过程和疾病机制具有重要意义。接下来,让我们一起探索这个奇妙的世界,揭开生物大分子相分离的神秘面纱。
什么是相分离
相分离是指在细胞质中,某些蛋白质和核酸(如DNA和RNA)能够自发地聚集在一起,形成类似于"液滴"的结构,而不依赖于膜的包裹。这些"液滴"可以在细胞内自由移动,同时保持其内部的分子组成相对稳定。这种现象类似于油和水在容器中自然分层的现象,但发生在细胞内的微观尺度上。
细胞中不仅存在膜结构细胞器,同时还含有许多生物大分子凝聚形成的无膜隔室。1835~1839年,研究人员在神经元细胞内发现第一个无膜隔室,后来被称为核仁(nucleoli)[1]。随后越来越多的研究又陆续发现许多不同的无膜隔室。2009年,科学家发现秀丽隐杆线虫胚胎中RNA和蛋白质组成的P颗粒是由相分离形成的液滴[2]。2011年,同一实验室证实相分离也是核仁形成的基本原理[3]。光漂白恢复等实验表明,许多隔室可以持续地与周围的介质发生交换,相同类型的隔室在接触时发生融合。这种无膜隔室后来被称为无膜细胞器(membraneless organelles,MLOs),越来越多的数据证明相分离是细胞内MLOs形成的基础。

图1 实验中的生物大分子相分离
相分离的发生
相分离的过程主要由蛋白质和核酸表面的化学性质决定。当这些大分子达到一定浓度,或者在特定的化学环境下,它们之间的相互作用力超过了热运动的干扰,就会开始聚集。这个过程有点像你在一个派对上,当你遇到志同道合的人时,你们会自然而然地聚在一起聊天,而其他人则可能继续在房间的其他地方活动。
随着科学技术的发展,对生物分子相分离形成的无膜细胞器的了解也越来越清晰,对不同成分和功能的无膜细胞器的认识越来越深入。如图所示,MLOs包括核仁[4]、早幼粒细胞白血病蛋白核小体(promyelocytic leukemia nuclear bodies)[5]、应激颗粒(stress granules)[6]等。自发组装的液液相分离(liquid-liquid phase separation,LLPS)是MLOs的形成基础。MLOs成分被特异分割且高度浓缩在类液态液滴中,持续地与周围的水环境进行动态交换,这种方式可以促进或抑制特定的生化反应。同时,除LLPS液滴外,MLOs也可以表现为动态水凝胶或非动态类固体结构,而从水环境中分离出来[7]。相分离不仅增强了生物分子功能的专一性,还促进了细胞对内外环境变化的适应能力。
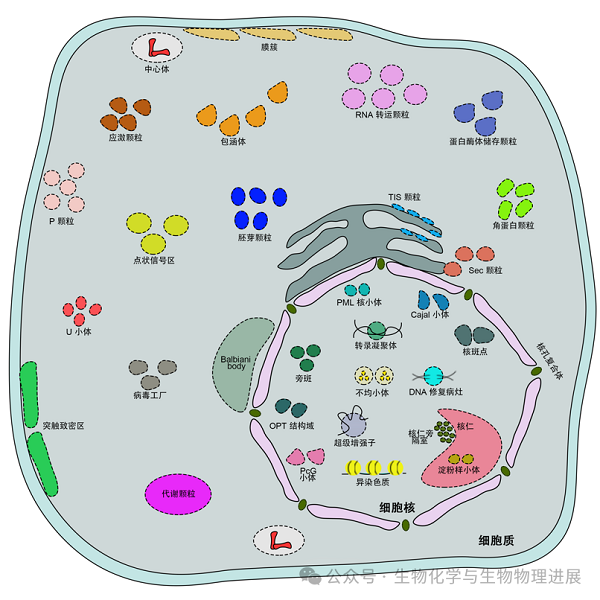
图2 细胞中的相分离形成的无膜细胞器
相分离的重要性
1、相分离与转录调控
想象一下,在细胞核的广阔空间中,DNA链宛如一条绵延不绝的长河,上面镶嵌着无数的基因珠子。这些基因珠子并不孤单,它们时刻被各种蛋白质和RNA分子围绕,形成一个个繁忙的工作站。然而,令人惊奇的是,这些工作站并非随意散布,而是通过一种名为"相分离"的现象,自发地聚集起来,形成类似于油水分离的微小液滴,被称为转录凝聚体。
真核生物RNA聚合酶II(RNAPII)负责转录合成所有mRNA,是决定基因表达、细胞生长、器官发育等重要生命活动的关键调控蛋白[8]。中介体参与调节转录的几乎所有阶段,包括转录起始、启动子逃逸、转录延伸、前mRNA加工和转录终止。目前研究最多的是中介体在转录因子DNA结合位点和基因启动子处的转录起始前复合体(RNAPII和一般转录因子组成)之间传递调控信号,同时促进或稳定转录起始前复合物的形成。研究表明,中介体和RNAPII在活胚胎干细胞中形成的稳定簇具有相分离凝聚体的特性,而且转录因子在超级增强子处也加入到该相分离凝聚体中[9]。在活细胞中发现低复杂度结构域(low-complexity domain,LCD)介导了RNAPII与转录因子或中介体共定位于凝聚体[10]。(详情请点击阅读原文)
2、相分离与癌症
癌症,一个令人生畏的名字,它背后隐藏的是细胞生长和分裂失去控制的秘密。正常情况下,细胞的生长和分裂受到严格调控,但当调控机制失灵,细胞开始无序增殖,肿瘤便逐渐形成。而相分离,作为细胞内物质组织的关键机制之一,其在癌症发展中的角色正逐渐被科学家们所揭示。
癌症的发生和发展是一个涉及多个基因与环境相互作用的动态过程。异常的LLPS已被用于解释一些癌症表型的基础机制。相分离在致癌转录失调过程中发挥重要作用,致癌转录失调是肿瘤发生和发展的关键驱动因素。TAZ家族蛋白激活多种癌症相关的转录因子(transcription factors,TFs),通过形成凝聚体增强TAZ特异性增殖基因的表达[11]。TAZ家族蛋白凝聚体在乳腺癌细胞中表现为多个分散的核点,而在正常乳腺细胞中没有发现[11]。在癌症细胞中,相分离异常可能导致某些致癌基因过度表达,或使抑癌基因沉默,从而促进肿瘤的发生和发展。
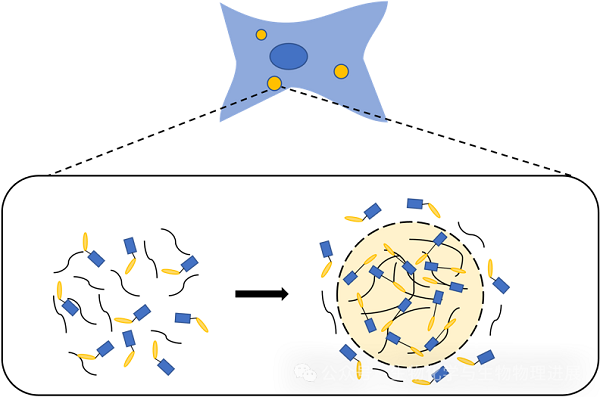
图3 疾病中的相分离凝聚体形成
展望未来
生物大分子相分离的研究正处于一个令人兴奋的阶段,其未来发展充满了无限可能。科学家们正致力于解开这一现象背后的分子机制,并探索其在生物学和医学领域的广泛应用。以下是几个研究方向,预示着生物大分子相分离未来的广阔前景:
1、疾病机理的深入理解
相分离与一系列神经退行性疾病、癌症等重大疾病的关联已经逐渐显现。例如,异常的蛋白质相分离可能导致蛋白质聚集,形成与阿尔茨海默病、帕金森病相关的病理特征。深入研究相分离的调控机制,有望揭示疾病的发病机理,为开发新的治疗方法提供理论依据。
2、细胞功能的精细化调控
细胞内的相分离事件涉及众多蛋白质和核酸分子的相互作用,它们共同构成了复杂的调控网络。未来的研究可能会揭示更多的相分离相关因子,以及它们如何协同作用以实现细胞功能的精确控制。这将有助于我们理解细胞如何应对各种生理和病理条件,为疾病预防和治疗提供新思路。
3、生物材料与药物递送系统的设计
受相分离启发的生物材料设计正在成为研究热点。利用蛋白质和核酸的相分离性质,可以开发新型的药物递送载体,实现靶向治疗和智能响应型药物释放。此外,相分离还可以用于构建人工细胞器或微反应器,模拟细胞内的生化反应,为合成生物学和组织工程学带来革新。
4、生物大分子相分离的技术应用
相分离现象本身也可能成为一种有用的实验技术。例如,利用特定条件下的相分离,可以实现生物大分子的富集和纯化,提高生物分析和诊断的灵敏度和特异性。此外,相分离还可以作为研究蛋白质互作和核酸结构的新平台,推动结构生物学的发展。
5、交叉学科的融合创新
生物大分子相分离的研究将促进物理学、化学、生物学和医学等多学科的交叉融合,催生出新的研究领域和方法。这不仅能够加深我们对生命过程的理解,还可能引领科学和技术的革命,开启生物医学研究的新纪元。
总之,生物大分子相分离的研究正站在科学探索的前沿,其未来的发展将极大地丰富我们对生命本质的认识,同时也为解决人类健康问题提供新的视角和工具。随着研究的不断深入,相信这一领域将会涌现出更多激动人心的发现和突破。
参考文献
[1] Pederson T. The nucleolus. Cold Spring Harb Perspect Biol, 2011, 3(3): a000638
[2] Brangwynne C P, Eckmann C R, Courson D S, et al. Germline P granules are liquid droplets that localize by controlled dissolution/condensation. Science, 2009, 324(5935): 1729-1732
[3] Brangwynne C P, Mitchison T J, Hyman A A. Active liquid-like behavior of nucleoli determines their size and shape inXenopus laevisoocytes. Proc Natl Acad Sci U S A, 2011, 108(11): 4334-4339
[4] Yoneda M, Nakagawa T, Hattori N, et al. The nucleolus from a liquid droplet perspective. J Biochem, 2021, 170(2): 153-162
[5] Ryabchenko B, Sroller V, Horníková L, et al. The interactions between PML nuclear bodies and small and medium size DNA viruses. Virol J, 2023, 20(1): 82
[6] Wang L, Yang W, Li B, et al. Response to stress in biological disorders: Implications of stress granule assembly and function. Cell Prolif, 2021, 54(8): e13086
[7] Zhang H, Ji X, Li P, et al. Liquid-liquid phase separation in biology: mechanisms, physiological functions and human diseases. Sci China Life Sci, 2020, 63(7): 953-985
[8] Schier A C, Taatjes D J. Structure and mechanism of the RNA polymerase II transcription machinery. Genes Dev, 2020, 34(7/8): 465-488
[9] Cho W K, Spille J H, Hecht M, et al. Mediator and RNA polymerase II clusters associate in transcription-dependent condensates. Science, 2018, 361(6400): 412-415
[10] Chong S, Dugast-Darzacq C, Liu Z, et al. Imaging dynamic and selective low-complexity domain interactions that control gene transcription. Science, 2018, 361(6400): eaar2555
[11] Lu Y, Wu T, Gutman O, et al. Phase separation of TAZ compartmentalizes the transcription machinery to promote gene expression. Nat Cell Biol, 2020, 22(4): 453-464
作者简介
赵相东:河北农业大学生命科学学院微生物学专业,曾凡力教授课题组研究生主要致力于酿酒酵母RNA聚合酶Ⅱ亚基胞质凝聚体组分及特征解析。
(作者:赵相东)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: