卵母细胞"肖像"
卵母细胞是人体中最宽的单个细胞,直径约为100 μm,大约是普通体细胞的十倍。这种细胞不仅在体积上突出,而且在女性生殖过程中也扮演着至关重要的角色。女性刚出生时卵巢中就有数百万个原始卵泡,它们是孕育卵子的场所,每个卵泡内有初级卵母细胞,初级卵母细胞发育成熟后就是卵子。随着年龄的增长,卵母细胞的数量会逐渐减少。到了青春期,卵巢中通常剩下约30万~50万个卵母细胞,而在女性的一生中,只有大约400~500个卵母细胞能够成熟并排卵。卵母细胞的发育和成熟过程是一个复杂的周期性过程。每个月,在激素的调控下,卵巢中的多个卵泡开始发育,但通常只有一个卵泡能够完全成熟,排出一个成熟的卵母细胞,这个过程称为排卵(图1)[1]。
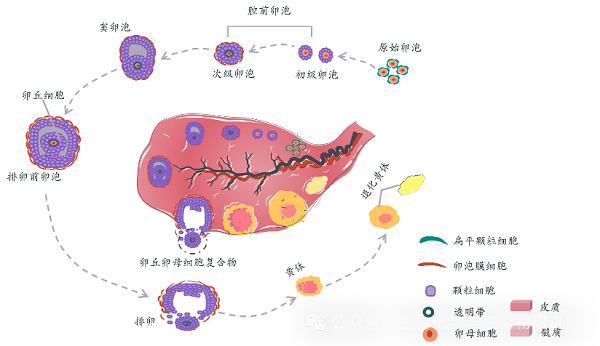
图1 卵泡发育过程
排出的卵母细胞进入输卵管,如果在这个过程中遇到精子并成功受精,它就会开始分裂并发育成胚胎,最终植入子宫内膜,开始妊娠。如果没有受精,卵母细胞会随月经排出体外。卵母细胞不仅在生殖中起关键作用,还通过分泌性激素,如雌激素和孕激素,调节女性的月经周期,影响骨骼健康和情绪状态等方面。这些激素在维持女性身体的正常功能方面发挥着重要作用。随着女性年龄的增加,卵母细胞的数量和质量都会下降。这就是为什么女性在30岁以后,尤其是35岁以后,怀孕的难度会增加,流产和胎儿染色体异常的风险也会上升。为了应对这一问题,越来越多的女性选择在年轻时冷冻卵子。这项技术允许女性在生育能力较高时冷冻保存自己的卵母细胞,以便未来在适当的时间使用,增加怀孕的机会。
卵母细胞冷冻保存之--"手动成球"
玻璃化冷冻是卵母细胞低温保存的常用方法,随着玻璃化冷冻技术的不断发展,卵母细胞冷冻保存后的存活率有所提高,但发育潜能还是显著低于新鲜卵母细胞。海藻酸钠水凝胶独特的三维网络结构在低温保存过程中或可限制冰晶形成与生长,维持细胞内外渗透压的缓慢变化,减少细胞损伤。图 2展示了几种较为简单的海藻酸钠水凝胶包封卵母细胞细胞的方法。这些手动制备的替代方案能够成功地将细胞封装在水凝胶微球中,并且操作过程温和,不会影响细胞在体外的进一步存活或发育。
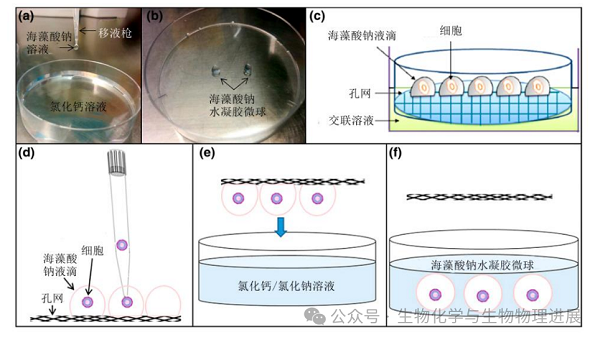
图2 手动制备海藻酸钠水凝胶微球的方法
(a-b)将海藻酸钠溶液和细胞混合液直接滴入氯化钙溶液中交联制备海藻酸钠水凝胶微球[2];(c)海藻酸钠和细胞混合溶液液滴置于网状物上,再浸泡入交联浴中形成微球[3];(d-f)将载有细胞和海藻酸钠溶液液滴的网格倒置在氯化钙溶液上方,然后快速摇动或轻敲,使液滴落入交联浴进而形成微球[4]。
卵母细胞冷冻保存之--"微球自动化"
微流控技术因其生成过程可控、且具有良好的生物相容,被认为是制备微球的实用可行方法。微流控技术微囊化细胞的过程首先是让细胞悬浮液(分散相)在不相溶流体(连续相)中乳化[5]。乳化后再通过物理和化学方法使液滴凝胶化。基于液滴的微流控芯片中可以独立进行液滴的生产、操作和应用。相比于手动包封,该方法的优点是可以高效形成单分散的液滴,并精确控制液滴的大小和形状,从而获得均匀分布的液滴尺寸。微流控芯片封装细胞可以用不同的几何结构实现,包括 T 字型、同向流动型和流动聚焦型[6](图3)。
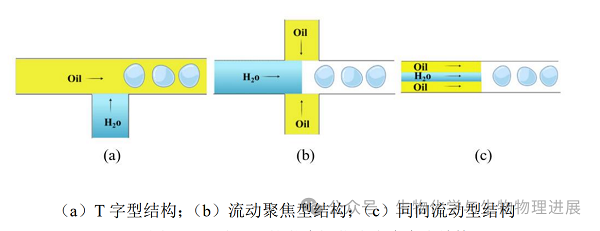
图3 三种不同的微流控芯片液滴生成结构
采用流动聚焦型微流控芯片,通过调整芯片结构、海藻酸钠溶液浓度和流速比,可以制备大小均匀、空包率低、低温耐受的载卵母细胞海藻酸钠水凝胶微球。玻璃化冷冻后,将载卵母细胞海藻酸钠水凝胶微球放入海藻糖+柠檬酸钠的稀释溶液中,卵母细胞即被释放(图4)。(详情请点击阅读原文)
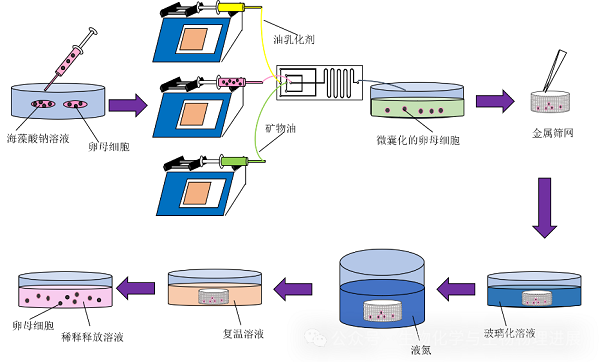
图4 卵母细胞的"自动包封"与释放
通过优化微流控芯片的喉部结构和交联结构,可以确定最佳制备参数,以稳定生成高分散性和均匀性微球。选用金属筛网作为冷冻载体,对微流控芯片制备的载卵母细胞海藻酸钠水凝胶微球进行玻璃化保存实验。以冷冻复温后卵母细胞的存活率和孤雌激活培养的发育率为检测标准,优化微球粒径、保护剂浓度、保护剂加载时长和复温释放程序,综合分析卵母细胞玻璃化冻存效果,可获得海藻酸钠水凝胶包封卵母细胞玻璃化保存的最优工艺。
展 望
在这个快速变化的时代,卵母细胞低温保存无疑是生殖健康领域的一项重要突破,赋予女性更多的生育权利和未来规划的自由。然而,目前卵母细胞冷冻保存技术仍面临一些技术瓶颈,例如冻后卵母细胞可能受到细胞膜损伤、骨架损伤、线粒体损伤等,使得卵母细胞的发育和受精受到影响。这些问题限制了卵母细胞冷冻保存的成功率和应用范围。为了克服这些瓶颈,研究人员正致力于开发更加有效的新型冷冻保护剂、创新性的冷冻和复温设备,优化冷冻和复温程序。此外,生殖医学领域的多学科合作也将推动卵母细胞冷冻保存技术的发展。通过与材料科学、工程学和分子生物学等领域的合作,研究人员可以开发出更先进的技术和设备,进一步提高卵母细胞冷冻保存的成功率和安全性。
总之,随着这些技术瓶颈的不断突破和改进方法的应用,卵母细胞冷冻保存技术将在未来取得更大的进展,为女性生育选择提供更大的自由和保障,同时也为不孕不育问题的解决提供更加有效的方案。这一技术的进步不仅具有重要的科学价值,还具有深远的社会意义,为女性的生殖健康和未来规划带来了更多可能性。
参考文献
[1] 申敬, 李维杰, 谭佳,等. 自然卵巢和人工卵巢保存生育力的研究进展. 生物工程学报, 2024, 40(5): 1469-1485
[2] Vanacker J, Luyckx V, Amorim C, et al. Should we isolate human preantral follicles before or after cryopreservation of ovarian tissue?. Fertil Steril, 2013, 99(5): 1363-1368.e2
[3] Park K E, Kim Y Y, Ku S Y, et al. Effects of alginate hydrogels on in vitromaturation outcome of mouse preantral follicles. Tissue Eng Regen Med, 2012, 9(3): 170-174
[4] Xu M, Banc A, Woodruff T K, et al. Secondary follicle growth and oocyte maturation by culture in alginate hydrogel following cryopreservation of the ovary or individual follicles. Biotechnol Bioeng, 2009, 103(2): 378-386
[5] Choi C H, Wang H, Lee H, et al. One-step generation of cell-laden microgels using double emulsion drops with a sacrificial ultra-thin oil shell. Lab Chip, 2016, 16(9): 1549-1555
[6] Velasco D, Tumarkin E, Kumacheva E. Microfluidic encapsulation of cells in polymer microgels. Small, 2012, 8(11): 1633-1642
作者简介
申敬:上海理工大学博士研究生,从事卵母细胞、卵巢组织低温保存相关研究。
(作者:申敬)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: