随着科技的发展,液体活检以微创、快捷、可反复取样的特性被大家广泛关注。循环肿瘤DNA(ctDNA)作为肿瘤检测标志物是液体活检中的检测对象之一,它是由肿瘤细胞凋亡、坏死等方式释放到循环系统中的小片段DNA,携带肿瘤组织中的拷贝数变异、基因重排等遗传信息,具有较高的准确性和安全性。
据研究显示,ctDNA片段长度在134~144 bp左右[1],目前对ctDNA的结构以及产生机制尚不清楚,需要科研人员的继续研究。ctDNA的半衰期较短,约15min~2h[2],因此可以实时取样,对疾病进行实时监测,但是在疾病早期阶段,血液中的ctDNA浓度较低,因此从血液中分离ctDNA并对其进行定量分析是具有挑战性的。
ctDNA检测技术
随着分子生物学技术的飞速发展,数字PCR(digital PCR,dPCR)[3]、二代测序(next-generation sequencing,NGS)[4]以及一些基于纳米技术的生物传感器都可以对ctDNA进行检测,并且具有较高的灵敏度和特异性。(详情请点击阅读原文)
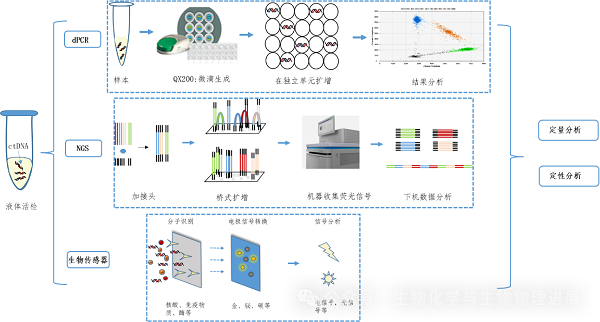
ctDNA主要检测技术的原理流程图
ctDNA在癌症诊疗中的运用
ctDNA的检测可运用到疾病管理过程中的各个阶段。
早期筛查。在癌症的早期,特别是在转移扩散之前,进行干预,可以提高患者的生存率。但是这个时期ctDNA的浓度较低,在大量野生背景下,对ctDNA进行准确定量具有挑战。
实时监测。在癌症治疗期间,连续的液体活检可以实时了解疾病进程,并及时调整治疗方案。鼠类肉瘤病毒癌基因(Kirsten rat sarcoma viral oncogene,KRAS)和神经母细胞瘤病毒癌基因RAS同系物(neuroblastoma RAS viral oncogene homolog,NRAS)作为表皮生长因子受体(Epithelial growth factor recepotor,EGFR)下游通路分子可介导EGFR的信号通路激活,引起对抗EGFR治疗耐药。据研究报道[5-6],对结直肠癌患者连续进行ctDNA监测发现,在抗EGFR治疗期间,KRAS突变呈阳性,而在停止抗EGFR治疗后,KRAS突变呈下降趋势,说明该治疗产生耐药反应,需调整治疗方案。连续的液体活检可以确定疾病进展或者是否产生新的突变,进而指导医生继续治疗或者选择新的治疗方案。
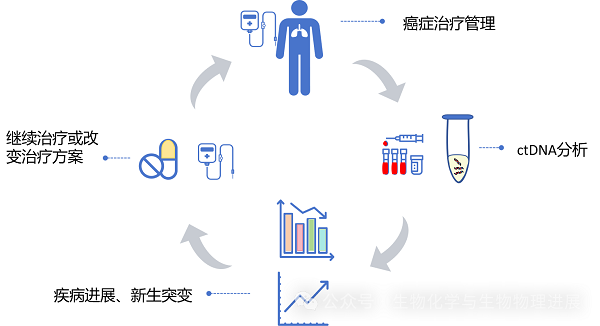
ctDNA的实时监测过程图
预后评估。患者在肿瘤手术后,一般会有较高的复发风险,因此,更好地评估微小残留病灶是癌症管理的关键。ctDNA分析可以作为复发监测工具。对20名长期随访的原发性乳腺癌患者进行ctDNA动态监测,有86%的患者提前11个月预测到复发风险[7]。
ctDNA分析开始从研究阶段过渡到临床环境。美国食品药品管理局(FDA)和欧洲药品管理局(EMA)已经批准对于非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者在无法进行肿瘤活检的情况下,可以对ctDNA中特定的基因突变进行分析,以供用药指导[8]。
小结与展望
尽管组织活检仍然是临床上使用的金标准,但是液体活检中ctDNA的检测以其微创、可实时取样、可反映癌症全面遗传信息的优势,吸引着大家不断探索。相信在不久的将来,ctDNA一定会在癌症的早期筛查、靶向药物选择、疾病进展的实时监测以及复发风险的预后评估等临床应用中大放异彩。
随着NGS和dPCR等技术的不断发展,对ctDNA的检测可达到较低的检出限,但是仍然存在实验室间检测结果的重复性和再现性较差的难题。因此,从样品的采集、储存、血液运输、提取方法以及定量检测等各个方面都需要制定统一规范的标准作业流程(standard operation procedure,SOP),并在有资质的实验室进行,才能保证实验结果的可信可比性,提高ctDNA的临床应用价值。
参考文献
[1] Underhill H R, Kitzman J O, Hellwig S, et al. Fragment length of circulating tumor DNA. PLoS Genet, 2016, 12(7): e1006162
[2] Waldeck S, Mitschke J, Wiesemann S, et al. Early assessment of circulating tumor DNA after curative-intent resection predicts tumor recurrence in early-stage and locally advanced non-small-cell lung cancer. Mol Oncol, 2022, 16(2): 527-537
[3] Moreno-Manuel A, Calabuig-Farinas S, Obrador-Hevia A, et al. dPCR application in liquid biopsies: divide and conquer. Expert Rev Mol Diagn, 2021,21(1): 3-15
[4] Deveson I W, Gong B, Lai K, et al. Evaluating the analytical validity of circulating tumor DNA sequencing assays for precision oncology. Nat Biotechnol, 2021, 39(9): 1115-1128
[5] Morelli M P, Overman M J, Dasari A,et al. Characterizing the patterns of clonal selection in circulating tumor DNA from patients with colorectal cancer refractory to anti-EGFR treatment. Ann Oncol, 2015, 26(4): 731-736
[6] Siravegna G, Mussolin B, Buscarino M, et al. Clonal evolution and resistance to EGFR blockade in the blood of colorectal cancer patients. Nat Med, 2015, 21(7): 795-801
[7] Olsson E, Winter C,George A,et al. Serial monitoring of circulating tumor DNA in patients with primary breast cancer for detection of occult metastatic disease. EMBO Mol Med, 2015, 7(8): 1034-1047
[8] Lindeman N I, Cagle P T, Aisner D L, et al. Updated molecular testing guideline for the selection of lung cancer patients for treatment with targeted tyrosine kinase inhibitors: guideline from the college of American pathologists, the international association for the study of lung cancer, and the association for molecular pathology. J Thorac Oncol, 2018, 13(3): 323-358
作者简介
张洁洁:上海海洋大学硕士研究生,研究方向为核酸计量。
(作者:张洁洁)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: