线粒体是绝大多数细胞的能量合成和代谢的场所,通过氧化磷酸化产生ATP为细胞供能。同时,线粒体还在脂肪酸代谢、细胞钙的缓冲、活性氧产生及氧化应激中发挥重要作用。因此,线粒体的病变也与多种疾病密切相关。线粒体是一种动态细胞器,能够通过分裂和融合生理过程维持线粒体形态功能的稳态。线粒体不断经历融合在细胞内形成一个网络样结构--线粒体网络。通过分裂形成两个线粒体,而分裂的受损线粒体则进一步被溶酶体清除,从而维持细胞内正常的线粒体功能。此外,线粒体可以在细胞之间通过纳米通道或囊泡进行交换(图1),健康线粒体进入线粒体受损的细胞内能够改善受体细胞内线粒体总体功能。因此,将健康线粒体移植入病变细胞内,使其发挥改善病变的作用成为可能。
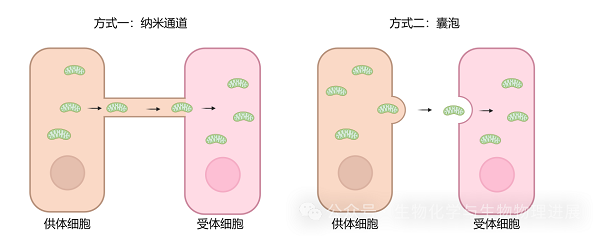
图1 线粒体在细胞之间交流的方式(图片素材来自Biorender)
线粒体移植是将外源性健康线粒体以直接或间接方式移植进入受损机体,从而改善受体细胞功能,最终达到改善或治疗疾病的目的。线粒体移植方式分为直接移植和间接移植两种(图2)。直接移植是指移植的是线粒体本身,间接移植是指移植携带线粒体的其他载体,例如细胞。目前的相关研究中,用于直接移植的线粒体来源包括3种:各细胞系、人脐带间充质干细胞以及组织。其中,组织来源线粒体主要取自于骨骼肌、胎盘、肝脏、脑和血小板等。同时提纯的自体、同种异体和异种线粒体或携带线粒体的载体可以通过血液注射或者原位注射进入受体细胞,从而增加受体细胞线粒体氧化磷酸化功能(生成能量的过程)及减少受损线粒体产生的有害物质,例如活性氧(ROS),并进一步改善受损的细胞功能,促进受体细胞的生长,最后改善或延缓疾病的发生及进展。
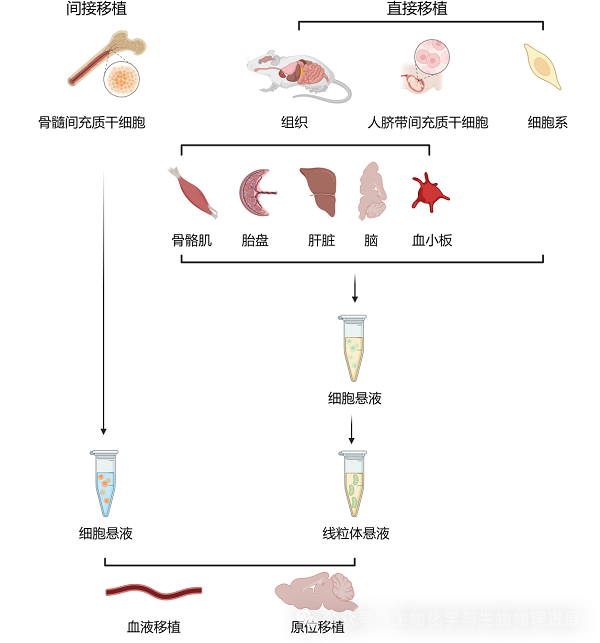
图2 线粒体移植的来源及方式(以神经系统为例)(图片素材来自Biorender)
目前已有的研究报道了线粒体移植在肿瘤[2]、心肌缺血性损伤[3]、脑损伤[4]以及神经退行性病变[5]等疾病治疗中的应用。除了基础研究外,2017年,波士顿儿童医院[6]将从患儿肌肉中提取的健康线粒体移植给5名先天性心脏病患儿,其中4名患儿的心室功能得到改善。2018年,中山大学附属第六医院为一名试管婴儿助孕失败的女士进行了线粒体移植,将其骨髓细胞内线粒体移植入其卵母细胞内[7],该尝试改善了患者胚胎的质量。
尽管线粒体移植的相关研究很多,但线粒体移植的研究并没有一个规范化的实验操作方案,且其作用效果差异大。因此,利用线粒体移植作为疾病治疗的研究方案仍需进一步的探索。具体探索的方面包括:
线粒体的来源。考虑到线粒体移植方法未来在临床应用的可能性,来源于细胞系、人脐带间充质干细胞以及自体或异体实体组织的线粒体并不适用。一种可再生可持续获取的线粒体来源亟待探索,例如:自体或异体的血液细胞内线粒体。
离体线粒体的保存。鉴于线粒体储存于冷藏或冷冻状态超过1小时,线粒体就会发生损伤。目前有望于应用于临床的线粒体保存方式,储存时间最长不超过2天。然而由于线粒体移植的维持时间可达4周,这意味着将线粒体作为治疗疾病的方案需要持续移植,因此更长时长的离体线粒体储存方式仍需探究。
线粒体移植的量。目前的相关研究通常采用线粒体蛋白的含量或线粒体的个数作为计数单位。根据线粒体移植的方式不同,线粒体的起效量也具有显著差异,其中通过脉管移植起效量较大,原位移植较小。能够发挥作用的线粒体的量通常为10~750 mg线粒体蛋白或1×105~1×107个线粒体。
线粒体移植效率。由于线粒体不具有靶向识别受体细胞的能力,导脉管移植的效率显著低于原位移植。而包括神经系统疾病在内的原位移植方式在临床应用具有局限性,故探索一种新的能够使供体细胞线粒体靶向识别受体细胞的方法将成为线粒体移植研究领域的重要研究方向。
线粒体移植在多种系统疾病的相关研究越来越多,现有的研究表明,线粒体移植可以恢复受损细胞的线粒体功能和活力,同时,该领域已具备一定的临床研究基础。尽管目前对其实施仍有争议,但在未来的研究中,线粒体移植可能成为一种治疗线粒体损伤相关疾病的新方案。(详情请点击阅读原文)
参考文献
1. Clark M A, Shay J W. Mitochondrial transformation of mammalian cells. Nature, 1982, 295(5850): 605-607
2. Chang J C, Chang H S, Wu Y C, et al. Mitochondrial transplantation regulates antitumour activity, chemoresistance and mitochondrial dynamics in breast cancer. J Exp Clin Cancer Res, 2019, 38(1): 30
3. Masuzawa A, Black K M, Pacak C A, et al. Transplantation of autologously derived mitochondria protects the heart from ischemia-reperfusion injury. Am J Physiol Heart Circ Physiol, 2013, 304(7): H966-H982
4. Zhao J, Qu D, Xi Z, et al. Mitochondria transplantation protects traumatic brain injury via promoting neuronal survival and astrocytic BDNF. Transl Res, 2021, 235: 102-114
5. Chang J C, Wu S L, Liu K H, et al. Allogeneic/xenogeneic transplantation of peptide-labeled mitochondria in Parkinson's disease: restoration of mitochondria functions and attenuation of 6-hydroxydopamine-induced neurotoxicity. Transl Res, 2016, 170: 40-56.e3
6. Emani S M, Piekarski B L, Harrild D, et al. Autologous mitochondrial transplantation for dysfunction after ischemia-reperfusion injury. J Thorac Cardiovasc Surg, 2017, 154(1): 286-289
7. 蔡敏婕, 简文杨. 世界首例" 线粒体移植婴儿" 广州出院. 家庭医学: 下, 2018(6): 4
作者简介
李淑娇:空军军医大学基础医学院教学实验中心博士研究生,研究方向为中枢神经系统疾病线粒体机制研究。
郑倩雯:空军军医大学第一附属医院肝胆外科硕士研究生,研究方向为线粒体自噬与肿瘤相关机制研究。
(作者:李淑娇、郑倩雯)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: