"民以食为天",这则耳熟能详的成语深深地烙印在华夏儿女们的心中,足以体现中华民族对饮食的重视。但近年来,人们大多处于能量摄入过剩,而能量消耗过少的能量失衡状态,这造成了人们长期的能量摄入过量和能量消耗缺乏。目前,肥胖和超重已成为全球瞩目的重大卫生问题,肥胖与多种代谢性疾病的发生发展相关,例如2型糖尿病、心脑血管疾病、代谢综合征和非酒精性脂肪肝病等,严重威胁人类的身心健康。

肥胖易感和肥胖抵抗
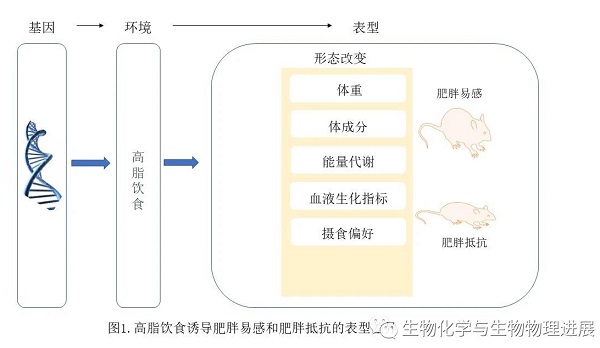
肥胖病因及其机制十分复杂,涉及遗传和环境因素之间复杂的相互作用,在这些因素的作用下,肥胖在人类及啮齿类动物中具有明显的异质性。脂肪供能比为40%~60%的高脂饮食(high-fat diet, HFD)能诱导肥胖的发生。但有趣的是,在既往构建食源性肥胖鼠(大鼠或小鼠)模型时,即使在相同高脂喂养条件和遗传背景下,仍会出现明显的个体差异。有的更容易出现肥胖,称之为肥胖易感(diet-induced obesity, DIO);反之,抵抗肥胖,即为肥胖抵抗(diet-induced resistance, DR)[1-3]。
DIO和DR的表型差异
目前两种表型的差异主要表现在体重与体成分、能量代谢、生化指标(如血脂四项、血糖、胰岛素、瘦素等)、行为学(如摄食偏好)等方面。
体重是肥胖易感与肥胖抵抗表型差异中最显著的表征,与正常饮食对照组相比,肥胖易感的小鼠体重和体重增加量显著增加,而肥胖抵抗小鼠体重无明显差异[4-6]。与肥胖抵抗小鼠相比,肥胖易感小鼠更易受HDF的影响,其会有更高体脂百分比和体脂量,并伴随着脂肪细胞直径和表面积明显增大[2, 7-8]。研究表明,HDF诱导的肥胖易感小鼠24小时摄入量、呼吸商、能量效率等较肥胖抵抗型鼠增加,而总能量消耗降低,表明肥胖易感小鼠能量失衡,能量摄入大于能量消耗。此外,肥胖易感小鼠血清胰岛素、瘦素水平显著升高,同时肝脏甘油三酯、总胆固醇、高密度脂蛋白、低密度脂蛋白和游离脂肪酸等指标也明显升高。肥胖易感性的表型差异可能受摄食脂肪和糖类偏好的影响[6]。
DIO和DR差异的可能机制
脂肪酸转位酶(fatty acid translocase, FAT/CD36)是一种脂肪酸受体,其主要功能是促进长链脂肪酸的摄取,并介导炎症和脂肪能量储存等过程。CD36的表达受脂肪摄入的调节,在肥胖患者和HFD喂养的小鼠中发现CD36的表达上升,同样,在肥胖易感小鼠大鼠舌外周乳头或十二指肠也观察到CD36 mRNA水平增加而在CD36敲除小鼠中发现其对HDF的偏好降低[9-10]。此外,在人群研究中发现,CD36基因型影响人们的糖脂摄入量[11]以及脂肪摄入习惯[12],由此表明,CD36可能是HFD诱导不同肥胖表型的关键蛋白。
脂肪、肝脏和骨骼肌是人体重要的代谢组织和器官,在能量代谢和稳态的调节过程中发挥着重要的作用。这些组织器官蛋白表达和脂质代谢的差异,可能是发生表型差异的机制。(详情请点击阅读原文)
胃肠道激素水平和炎症在HFD诱导的不同肥胖表型有着显著差异,与肥胖抵抗型相比,肥胖易感小鼠胃肠道中胰高血糖素原mRNA、生长激素释放肽2以及禁食条件下的胃饿素水平更高,而饱腹感激素胰高血糖素样肽1(GLP-1)水平和和结节神经节 GLP-1R mRNA 显著降低[13]。HFD可诱导全身慢性炎症反应,并促使肥胖易感型肠道发生炎症,研究者发现,肥胖易感型回肠Toll样受体4(TLR4)等蛋白质水平升高,促使炎症因子IL-6、TNF-α的分泌并使该表型肠道相关酶活性降低使其通透性增加,促使肠道炎症发生,可能诱导了肥胖的发生。肠道微生物菌群参与调节宿主的肠道稳态,其将肠道信号传到外周中枢形成肠-脑轴信号通路,肠道微生物菌群和该信号通路功能改变可影响机体进食和脂质饱腹感反应,可能是肥胖易感性差异的原因。
下丘脑-垂体-甲状腺(hypothalamic-pituitary-thyroid, HPT)轴负反馈调节可维持甲状腺激素(TH)水平的稳定。HPT轴功能紊乱可影响TH水平,进而影响肥胖易感性。下丘脑是调节能量平衡和食欲的高级中枢,与肥胖抵抗型相比,肥胖易感型下丘脑弓状核瘦素受体(LEPR)、促肾上腺皮质激素释放激素(CRH)mRNA、前原神经肽(prepro-NPY)、NPY 及其受体 Y1、Y2、Y5 mRNA,以及PPAR-γ mRNA表达水平更高,POMC mRNA水平降低[14-15],以上变化可促使食物摄入量增加,能量消耗降低,脂肪堆积。
通常认为肥胖的发生受环境和遗传因素的共同影响,遗传因素可增加机体对肥胖的易感性。目前,已有多项研究在全基因组水平上分析了胞嘧啶(C)甲基化(cytosine (C) methylation, CpG)位点的DNA甲基化及其与常见肥胖、肥胖与脂肪组织分布相关的临床变量的潜在关系。(详情请点击阅读原文)

展望
尽管已有大量关于肥胖易感和肥胖抵抗表型差异的研究成果,但仍有很多方面尚未得到充分阐明和揭示,如表型特征改变是肥胖程度导致的结果还是原因,基因型与表型间的关系及发病机制,基因型改变如何影响生物学功能进而影响表型等。因此,寻找两种表型的差异基因,并探讨其差异表达的原因和机制,将是下一阶段研究的热点。针对差异表达基因引起的生物学进程改变,揭示肥胖发生发展的机制,将有助于寻找更多的肥胖易感基因和治疗靶点。
参考文献
[1] 张梦洁, 包艳. 饮食性肥胖抵抗的研究现状. 现代预防医学, 2018, 45(11): 1957-1959+1979
[2] Jackman M R, Maclean P S, Bessesen D H. Energy expenditure in obesity-prone and obesity-resistant rats before and after the introduction of a high-fat diet. Am J Physiol Regul Integr Comp Physiol, 2010, 299(4): R1097-R1105
[3] Inbar D, Gendelis S, Mesner S, et al. Chronic calorie-dense diet drives differences in motivated food seeking between obesity-prone and resistant mice. Addict Biol, 2020, 25(3): e12753
[4] Xia S F, Duan X M, Hao L Y, et al. Role of thyroid hormone homeostasis in obesity-prone and obesity-resistant mice fed a high-fat diet. Metabolism, 2015, 64(5): 566-579
[5] Choi J Y, Mcgregor R A, Kwon E Y, et al. The metabolic response to a high-fat diet reveals obesity-prone and -resistant phenotypes in mice with distinct mRNA-seq transcriptome profiles. Int J Obes (Lond), 2016, 40(9): 1452-1460
[6] Boi S K, Buchta C M, Pearson N A, et al. Obesity alters immune and metabolic profiles: new insight from obese-resistant mice on high-fat diet. Obesity (Silver Spring, Md), 2016, 24(10): 2140-2149
[7] Allerton T D, Primeaux S D. High-fat diet differentially regulates metabolic parameters in obesity-resistant S5B/Pl rats and obesity-prone Osborne-Mendel rats. Can J Physiol Pharmacol, 2016, 94(2): 206-215
[8] Chang S, Graham B, Yakubu F, et al. Metabolic differences between obesity-prone and obesity-resistant rats. Am J Physiol, 1990, 259(6 Pt 2): R1103-R1110
[9] Douglas Braymer H, Zachary H, Schreiber A L, et al. Lingual CD36 and nutritional status differentially regulate fat preference in obesity-prone and obesity-resistant rats. Physiol Behav, 2017, 174: 120-127
[10] Primeaux S D, Braymer H D, Bray G A. CD36 mRNA in the gastrointestinal tract is differentially regulated by dietary fat intake in obesity-prone and obesity-resistant rats. Dig Dis Sci, 2013, 58(2): 363-370
[11] Pioltine M B, De Melo M E, Santos A, et al. Genetic variation in CD36 is associated with decreased fat and sugar intake in obese children and adolescents. J Nutrigenet Nutrigenomics, 2016, 9(5-6): 300-305
[12] Ramos-Lopez O, Roman S, Martinez-Lopez E, et al. CD36 genetic variation, fat intake and liver fibrosis in chronic hepatitis C virus infection. World J Hepatol, 2016, 8(25): 1067-1074
[13] Primeaux S D, Barnes M J, Braymer H D, et al. Sensitivity to the satiating effects of exendin 4 is decreased in obesity-prone Osborne-Mendel rats compared to obesity-resistant S5B/Pl rats. Int J Obes (Lond), 2010, 34(9): 1427-1433
[14] Huang X F, Han M, Storlien L H. The level of NPY receptor mRNA expression in diet-induced obese and resistant mice. Brain Res Mol Brain Res, 2003, 115(1): 21-28
[15] Wang C, Yang N, Wu S, et al. Difference of NPY and its receptor gene expressions between obesity and obesity-resistant rats in response to high-fat diet. Horm Metab Res, 2007, 39(4): 262-267
作者简介
宋诗语:广州体育学院国家体育总局运动技战术诊断与机能评定重点实验室研究生,研究方向:运动与健康促进/运动与慢性代谢性疾病。
秦莲:广州体育学院国家体育总局运动技战术诊断与机能评定重点实验室研究生,研究方向:体育保健与康复/运动与慢性代谢性疾病。
(作者:宋诗语、秦莲)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: