适配体又称"人工抗体"、"化学抗体",是从大容量的寡核苷酸文库中,经指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)反复进化筛选获得的短链RNA或单链DNA(ssDNA)序列,自身可折叠或在靶分子诱导下形成一定的三维结构,从而与靶分子发生高亲和力、高选择性结合作用。Larry Gold[1]是SELEX技术的奠基人之一,他申请了SELEX知识产权保护,核心专利刚刚于2022年到期,其创办的SomaLogic公司目前是小核酸药物的优势公司。适配体与抗体相比,亲和力相当或稍弱,但选择性较强,具有成本低、可体外合成、可化学修饰、可DNA工程化等优势[2]。近20年来,核酸适配体研究在生物传感、成像诊断、药物及递送载体等方面一直是热点领域[3]。
SELEX技术一般通过文库建立、靶分子结合、分离、扩增的循环进行,重复多轮筛选后得到结构化的核酸适配体序列。SELEX技术的核心有四点(表1):①核酸分子文库,两端引物需尽量设计不参予中间随机序列的进化;②筛选方案,前几轮和后几轮的进化压力(文库浓度/靶分子浓度比值、盐浓度等)应该不同;要得到高质量的适配体,一般需加入反筛步骤,以及尽量创造和实际样品应用场景相同或相似的筛选环境,例如血清/血浆、细胞培养基等;③文库与靶分子的分离方式,SELEX发展至今已逾30年,所探索的分离方式超50余种,较为成熟、可靠的方式包括亲和磁珠法(直接结合或竞争结合方式)[4]、Cell-SELEX[5]、石墨烯-SELEX[6]、毛细管电泳-SELEX[7]等;④评价手段,边筛选边评价的方式最为理想。目前已经出现了荧光法、表面等离子体共振技术(surface plasmon resonance,SPR)[8]、等温滴定量热技术[9]、生物膜干涉技术[10]以及酶联适配体吸附测定等表征评价方法,高通量测序也是一种较好的评价手段。要注意的一点是,不同表征评价方法得到的亲和力可能存在一定差异,一般认为平衡解离常数在2~3倍范围内都是合理的。
通过SELEX技术所获得的适配体由两端固定引物和中间的一段非引物序列组成,典型全长为70~130 nt,但绝大多数情况下,参与靶分子识别的只有20~50 nt不等的核心识别区域序列[11]。因此在适配体应用前需要进行优化,目的是明确识别位点、提高其亲和力,以及增加其稳定性。
目前尚无标准的适配体优化方案。主要思路通过结构剪裁、定点突变以及化学修饰等进行[12]。目前多数结构剪裁工作从半经验的二级模拟结构出发,通过经验试错的方法进行。针对全长适配体的二级结构,人为界定其局部高级结构(茎环、假结、G-四联体等)后,再依据经验值去除未成环或配对的单链、缩短茎、去除小凸环、缩小环等手法获得更优适配体[13],再而通过定点突变以及化学修饰等确认结合位点、验证更优适配体的合理性。但上述路径随机性强、多依赖专家"直觉"、工作量大。
随着算力算法的迅速发展,分子对接策略在适配体评价方面起到一定的指导作用。虽然由于核酸适配体的柔性和富负电结构,其直接进行全柔性三维结构的预测存在理论计算和工作量上的难点,但可以依据适配体的二级结构和靶分子的三级结构,创建合理的半柔性对接方案。在高效便捷的完成适配体-靶分子的虚拟对接和评价的同时,还可以根据三维结构中可能的对接位点、作用姿态进一步完成结构剪裁。
河北科技大学和军事科学院军事医学研究院的合作团队,针对蓖麻毒素发展了以分子对接模拟为指导、灵活引入步进式序列群进行适配体优化的方案(图1)。(详情请点击阅读原文)

图1 分子对接指导适配体结构优化示意图
研究者针对高毒性蛋白蓖麻毒素(Ricin,RCA60)的3条全长适配体进行优化工作,通过截取两端引物区、保留特殊结构的方式获得了3条随机区适配体(L14r、P3r、L7r)并对其进行分子对接,根据分子对接结果参数预测三者具有良好的与RCA60结合能力(图2)。通过SPR对L14r、P3r、L7r进行亲和力评价,KD值分别下降至全长的9、1、2倍,这一结果说明了结构剪裁举措的有效性,也验证了分子对接的可信度。
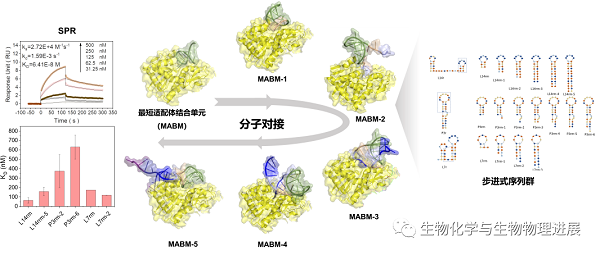
图2 L14r适配体分子对接结果
A) 适配体(绿色)与蓖麻毒素(黄色)结合姿势;B) 适配体(绿色)与蛋白活性口袋中关键氨基酸(紫色、橘色、粉色)详细结合情况;C) 适配体(绿色)与关键氨基酸(紫色、橘色、粉色)结合距离
为了更高效、更准确地筛选出更优适配体,避免"穷举"截短等工作量大的缺陷,研究者以分子对接模拟预测结果为指导,选取适配体与RCA60活性口袋所结合的序列部分,将之往外扩展至该部分能自折叠为一定的3D结构作为最短适配体结合单元,在确保适配体能进入靶蛋白活性口袋的基础上往外延长构建两端延长型的序列群(图3)。
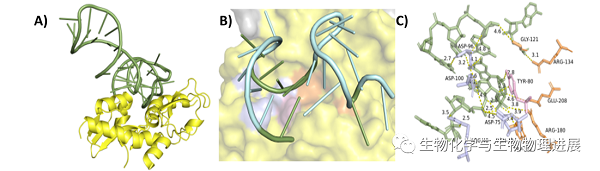
图3 L14r步进式序列群设计图
蓝色虚线框中为最短结合单元,两端向外逐渐延伸构成序列群,A、T、C、G颜色分别为深蓝、浅蓝、黄色、橘色
对步进式序列群进行分子对接,根据其结果参数进行筛选,分别挑选结果最优的两条序列通过SPR进行亲和力评价,筛选出3条最优适配体L14rm、P3r、L7rm-2,与RCA60的亲和力分别提高到全长适配体的14、1、4倍。
该策略中,根据适配体步进式序列群在毒素蛋白结合位点的姿态和对接分数差异,在三维的层面上对适配体的结构序列进行优化,极大减少了工作量,仅使用了17条适配体序列,就筛选得到了亲和力更强、序列最短的最优适配体。该策略除了对于普适性的适配体优化工作给出有益的指导之外,选择的目标蛋白为蓖麻毒素这一高毒性生物毒素蛋白,在工作中也以其他课题组筛选出来的SSRA1[14]为阳性对照完成了评价和优化策略的探讨。相信该工作筛选出来的3条最短适配体序列,能在国防与公共安全、毒素中毒诊断中发挥一定的积极价值。未来将进一步采用晶体学手段、多种相互作用表征技术等明晰最短适配体序列和蓖麻毒素的相互作用情况,包括相互作用位点、结合比、热力学和动力学特征等,以期为毒素蛋白传感、抑制剂研究提供数据基础。
参考文献
[1] Beutel BA, Gold L. In vitro evolution of intrinsically bent DNA. J Mol Biol, 1992, 228(3): 803-812
[2] Perret G, Boschetti E. Aptamer-based affinity chromatography for protein extraction and purification. Adv Biochem Eng Biotechnol, 2020, 174: 93-139
[3] Zhu G, Niu G, Chen X. Aptamer-drug conjugates. Bioconjug Chem, 2015, 26(11): 2186-2197
[4] 李世雨, 傅强, 严亚贤. 核酸适配体筛选的改良与优化策略. 生物技术通报, 2017, 33(11): 67-75
[5] Bing T, Zhang N, Shangguan D. Cell-SELEX, an effective way to the discovery of biomarkers and unexpected molecular events. Adv Biosyst, 2019, 3(12): e1900193
[6] Liu B, Zhao Y, Jia Y, et al. Heating drives DNA to hydrophobic regions while freezing drives DNA to hydrophilic regions of graphene oxide for highly robust biosensors. J Am Chem Soc, 2020, 142(34): 14702-14709
[7] Tang J, Xie J, Shao N, et al. The DNA aptamers that specifically recognize ricin toxin are selected by two in vitro selection methods. Electrophoresis, 2006, 27(7): 1303-1311
[8] Luo L, Yang J W, Li Z, et al. Label-free differentiation andquantification of ricin, abrin from their agglutinin biotoxins by surface plasmon resonance. Talanta, 2022, 238(Pt 1): 122860
[9] Su H X, Xu Y C. Application of ITC-Based characterization of thermodynamic and kinetic association of ligands with proteins in drug design. Front Pharmacol, 2018, 9: 1133
[10] Gao S X, Zheng X, Hu B, et al. Enzyme-linked, aptamer-based, competitive biolayer interferometry biosensor for palytoxin. Biosens Bioelectron, 2017, 89(Pt 2): 952-958
[11] He X, Guo L, He J, et al. Stepping library-based post-SELEX strategy approaching to the minimized aptamer in SPR. Anal Chem, 2017, 89(12): 6559-6566
[12] Gao S, Zheng X, Jiao B, et al. Post-SELEX optimization of aptamers. Anal Bioanal Chem, 2016, 408(17): 4567-4573
[13] Huang PJ, Liu J. A DNA aptamer for theophylline with ultrahighselectivity reminiscent of the classic RNA aptamer. ACS Chem Biol, 2022, 17(8): 2121-2129
[14] Lamont E A, He L, Warriner K, et al. A single DNA aptamer functions as a biosensor for ricin. Analyst, 2011, 136(19): 3884-3895
作者简介
刘佳:河北科技大学化学与制药工程学院药学硕士,现于军事医学研究院联合培养。研究方向为药物分析。
郭磊:军事医学研究院毒物药物研究所研究员,博士生导师,主要研究方向为毒物检测与分析毒理学、药物分析。
吴海霞:河北科技大学化学与制药工程学院教师,研究员,研究方向为医药中间体合成。
(作者:刘佳、郭磊、吴海霞)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: