随着社会经济的发展、人们生活水平的不断提高,中国居民的超重和肥胖问题也在不断凸显。《中国居民营养与慢性病状况报告(2020年)》显示,中国成年居民超重肥胖率已经超过50%[1]。饮食不当是造成肥胖的重要原因,精加工食品、高糖、高脂肪食品的持续摄入为机体提供了超额能量。机械化和自动化为生活带来的便捷同时,体力活动减少、久坐时间增加的生活方式也成为造成肥胖的另一个主要风险因素。不健康饮食和缺乏身体活动使得机体能量的摄入大于消耗,过剩的热量以脂肪的形式储存在脂肪组织中导致脂肪过度积累造成肥胖。

肥胖是高血压、糖尿病、冠心病等慢性病的重要诱因,同时也会对生殖健康产生不良影响,尤其是对男性而言。近年来临床研究发现,与正常体重的受试者相比,超重和肥胖与无精子症或少精子症的患病率增加以及精子数量异常的风险显著增加有关[2],且随身体质量指数(BMI)的增加,精液浓度、精子活力、精液量等逐渐降低[3]。除了对精液参数产生诸多不利影响外,肥胖引起的勃起功能障碍、射精障碍、睾酮分泌减少、睾丸萎缩、生精细胞凋亡增加等皆可影响男性生育能力和生殖健康[4]。探究肥胖等代谢异常状态对男性生殖健康影响的机制,"细胞自噬"在其中起到一定的作用。
关于自噬
早在1963年,比利时科学家Christian de Duve就提出了"自噬(autophagy)"这一概念,他观察到有一种新型的囊泡负责运输细胞货物进入溶酶体进行降解,但这背后的分子机制直到30年后才被解开。日本分子细胞生物学家Yoshinori Ohsumi利用面包酵母定位了细胞自噬的关键基因,并进一步阐释了细胞自噬的核心调控机制,他也因此荣获了2016年诺贝尔生理学或医学奖。
自噬是依靠溶酶体的保守的自我消化过程,通过清除蛋白质聚集体、受损细胞器和脂滴起到维持细胞内稳态的保护作用[5]。目前,哺乳动物细胞自噬主要可分为巨自噬(macroautophagy)、微自噬(microautophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)。巨自噬被认为是自噬的主要类型,研究也最为广泛。因此,我们通常将巨噬称为"自噬"。
自噬在人体各组织中普遍存在,为细胞更新和稳态提供底物和能量。UNC-51样激酶1(ULK-51-like kinase 1,ULK1)是调控自噬启动的关键因子。ULK1活化后进一步促进下游Bcl-2相互作用蛋白( Bcl-2 interacting coiled-coil protein 1,Beclin1)的激活,促使自噬通路的启动[6]。在自噬启动后,首先形成自噬泡,随后自噬泡不断向外延伸,将细胞内的细胞器等物质包裹,形成双层膜结构的自噬体[7],这一过程需要自噬标志物微管相关轻链蛋白3(microtubule-associated protein 1-light chain 3,LC3)的参与,LC3以LC3Ⅰ、LC3Ⅱ两种形式存在,自噬激活状态下,LC3Ⅰ结合磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)形成 LC3Ⅱ,LC3Ⅱ定位于自噬体膜上并参与自噬膜的形成与延伸[8]。选择性自噬接头蛋白1(sequestosome-1,SQSTM1/p62)是链接LC3Ⅱ与泛素化蛋白之间的桥梁,LC3Ⅱ与p62蛋白结合形成选择性自噬受体,同时,p62结合泛素化蛋白后进入到自噬体中,与溶酶体融合形成自噬溶酶体最终被降解[9]。
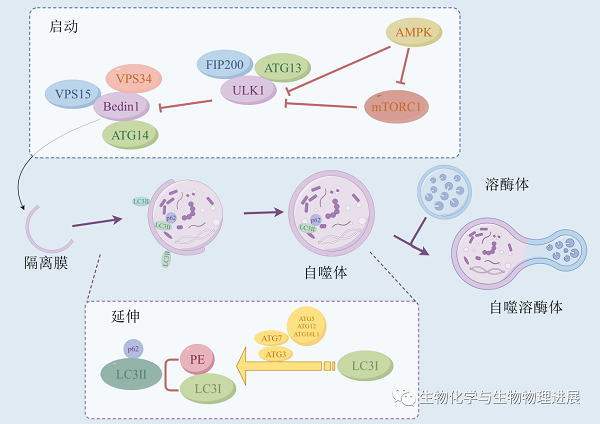
自噬过程
自噬紊乱的不良影响
自噬的稳态调节对于维持正常的能量稳态至关重要。在脂肪组织中,脂肪合成、脂肪组织分化和脂肪因子分泌等都需要自噬的参与,而在肥胖状态下脂肪组织的自噬程度也会发生一定的改变。自噬与肥胖的关系较为复杂,为了对伴随肥胖的低度炎症状态进行负向调控,组织内自噬水平提高。但过度激活的自噬也能够使脂肪干细胞分化成白色脂肪细胞,导致肥胖程度进一步加深,在一定程度上造成了恶性循环。同时,脂肪细胞中自噬泡降解过程受阻,自噬通量受到抑制,会导致脂质代谢异常,也会造成脂质蓄积[10]。功能失调的脂肪自噬会导致脂肪组织的扩张、代谢性血脂异常等,从而导致肥胖相关合并症的发生。
自噬过程的异常也会影响睾丸功能和精子的正常发生,特异性敲除雄性小鼠的ATG5基因后,其睾丸内自噬活性抑制,精子顶体形成异常,精子活力下降[11]。抑制Beclin1复合体形成或干扰自噬囊泡融合,可使精原细胞无法进行减数分裂并导致睾丸形态结构异常[12]。脂肪过度堆积导致的脂毒性损伤可能会抑制睾丸组织中的自噬。南京体育学院徐瑞团队研究发现,高脂饮食可导致大鼠睾丸组织形态结构的改变,并伴随自噬活性降低,睾丸中自噬相关蛋白LC3Ⅱ生成减少,P62降解减少。(详情请点击阅读原文)
运动改善自噬紊乱
长期规律运动能改善体内糖脂代谢,增强脂肪消耗,有效降低体脂,防治肥胖的发生发展。特异性敲除小鼠脂肪组织中自噬基因ATG7,可使小鼠表现出脂肪组织减少,脂肪细胞减小,脂肪酸氧化速率增加,体重减低[13]。而这与运动对肥胖的作用具有很大的相似性,因此,可以推测自噬与运动之间是存在关联的。更有趣的是,运动对白色脂肪组织自噬的调控具有组织差异性,在皮下脂肪中表现为启动自噬,在睾周脂肪中表现为抑制自噬[14]。但脂肪与自噬的关系较为复杂,脂肪自噬在运动调节脂代谢中的作用及机制还有待进一步探究。
运动具有很多健康效益,除了所熟知的防治心血管疾病、糖尿病外,运动还可以改善男性生殖健康。适当强度和时间的运动首先可以对下丘脑-垂体-性腺(hypothalamic-pituitary-gonadal,HPG)轴产生影响,提高促黄体生成素、促卵泡激素水平,增加了对睾丸支持细胞和间质细胞的刺激,促进了睾酮合成。睾酮是体内主要的雄性激素,对于男性生殖器官的发育、精子的合成至关重要。此外,也有研究发现,长期的有氧运动能有效提高睾丸组织中抗氧化、抗炎症能力,减少氧化应激损伤、炎症水平、细胞凋亡、DNA损伤[15-16]。运动还可通过适度上调细胞自噬水平降解细胞内的代谢废物和损伤细胞器,从而维持细胞正常的稳态效应,改善能量过剩条件下的睾丸组织损伤。南京体育学院徐瑞团队研究运动干预对肥胖大鼠睾丸自噬和凋亡的影响,发现8周中等强度运动干预能使大鼠睾丸组织中脂滴沉积现象明显减少,生精细胞层数和精子数量增加,睾丸组织损伤的改善伴随着自噬水平提高LC3Ⅱ/Ⅰ比值升高,p62蛋白表达降低。(详情请点击阅读原文)
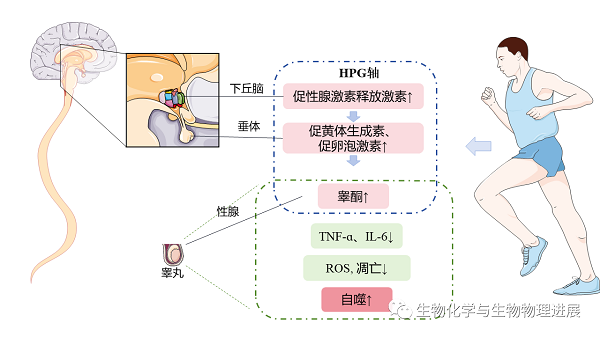
运动对生殖健康的影响
小结与展望
近年来肥胖导致雄性生殖功能障碍不断增加,随着研究进一步深入,肥胖诱发的生殖功能障碍可能是由于睾丸相关细胞自噬功能异常所致。运动干预可有效防止肥胖的发生发展,并改善肥胖导致的生殖功能障碍,这种改变可能与提高睾丸组织中的自噬水平并抑制细胞凋亡有关。自噬已成为近年来治疗肥胖、2型糖尿病等代谢相关疾病的核心。但目前运动干预对自噬的影响研究尚少,且运动干预调节自噬的分子机制尚未明确。相信随着研究的不断深入,必将为运动改善肥胖及肥胖导致的睾丸组织损伤、生殖功能障碍提供更多理论基础。
参考文献
[1] 中国居民肥胖防治专家共识. 中国预防医学杂志, 2022, 23(5): 321-339
[2] Sermondade N, Faure C, Fezeu L, et al. BMI in relation to sperm count: an updated systematic review and collaborative meta-analysis. Hum Reprod Update, 2013, 19(3): 221-231
[3] Eisenberg M L, Kim S, Chen Z, et al. The relationship between male BMI and waist circumference on semen quality: data from the LIFE study. Hum Reprod, 2015, 30(2): 493-494
[4] Davidson L M, Millar K, Jones C, et al. Deleterious effects of obesity upon the hormonal and molecular mechanisms controlling spermatogenesis and male fertility. Human fertility (Cambridge, England), 2015, 18(3): 184-193
[5] Mizushima N, Komatsu M. Autophagy: renovation of cells and tissues. Cell, 2011, 147(4): 728-741
[6] Egan D F, Shackelford D B, Mihaylova M M, et al. Phosphorylation of ULK1 (hATG1) by AMP-activated protein kinase connects energy sensing to mitophagy. Science, 2011, 331(6016): 456-461
[7] Yang Z, Klionsky D J. An overview of the molecular mechanism of autophagy. Curr Top Microbiol Immunol, 2009, 335: 1-32
[8] Runwal G, Stamatakou E, Siddiqi F H, et al. LC3-positive structures are prominent in autophagy-deficient cells. Sci Rep, 2019, 9(1): 10147
[9] Lamark T, Svennign S, Johansen T. Regulation of selective autophagy: the p62/SQSTM1 paradigm. Essays Biochem, 2017, 61(6): 609-624
[10] Mizunoe Y, Sudo Y, Okita N, et al. Involvement of lysosomal dysfunction in autophagosome accumulation and early pathologies in adipose tissue of obese mice. Autophagy, 2017, 13(4): 642-653
[11] Huang Q, Liu Y, Zhang S, et al. Autophagy core protein ATG5 is required for elongating spermatid development, sperm individualization and normal fertility in male mice. Autophagy, 2021, 17(7): 1753-1767
[12] Varga V B, Schuller D, Szikszai F, et al. Autophagy is required for spermatogonial differentiation in the Drosophila testis. Biol Futur, 2022, 73(2): 187-204
[13] Singh R, Xiang Y, Wang Y, et al. Autophagy regulates adipose mass and differentiation in mice. The J Clin Invest, 2009, 119(11): 3329-3339
[14] 周其姝. 高脂饮食和运动干预对大鼠白色脂肪自噬启动相关蛋白的影响[D]; 北京体育大学, 2020
[15] Alhashem F, Alkhateeb M, Sakr H, et al. Exercise protects against obesity induced semen abnormalities via downregulating stem cell factor, upregulating Ghrelin and normalizing oxidative stress. EXCLI J, 2014, 13: 551-572
[16] Tolouei Azar J, Habibi Maleki A, Moshari S, et al. The effect of different types of exercise training on diet-induced obesity in rats, cross-talk between cell cycle proteins and apoptosis in testis. Gene, 2020, 754: 144850
作者简介
徐瑞:博士,南京体育学院副教授,硕士研究生导师,研究方向为运动与体质健康,运动与肥胖。
董佳:北京体育大学运动人体科学硕士研究生,研究方向为运动与肥胖。
(作者:董佳、徐瑞)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: