几十年来,组织学技术一直是通过组织切片来研究基本结构和病理变化,然而,将信息限制在二维(2D)层面仅提供了一部分有用的空间结构,已不能满足日益深入的研究[1-2]。近年来组织透明化技术(Tissue Clearing)的出现为组织学可视化研究开辟了一个新时代,可在不切片及保留组织完整性的条件下通过组织透明化处理充分展现厚组织或完整器官在三维(3D)空间的高分辨结构,在细胞和亚细胞水平呈现整个生物样本信息,为分析不同结构成分的空间相关性提供了更多的可能[3-4]。
中国中医科学院针灸研究所白万柱研究员的团队一直从事针灸形态学的研究,在组织学方面积累了丰富的经验[5-6]。他们采用一种将免疫荧光组织染色技术与基于溶剂的组织透明化技术相结合的新方案呈现皮肤中丰富的神经血管分布。由于耳廓皮肤易整体分离,同时也是神经血管丰富的区域[7-8],他们以小鼠耳廓作为典型测试部位,用来整体显示皮肤中的神经血管网络。采用蛋白基因产物9.5(PGP 9.5)和鬼笔环肽(Phalloidin)分别标记小鼠耳廓皮肤中的神经纤维和血管,并通过全景组织切片扫描成像系统和激光扫描共聚焦显微镜对比经透明化处理前后的神经纤维和血管标记的成像效果。
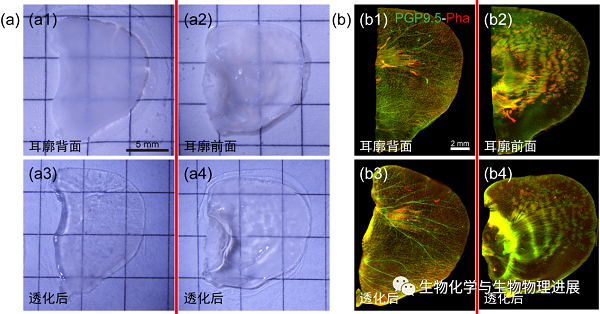
图1 小鼠耳廓皮肤经透明化处理前后的外观及成像效果对比图
首先,全景组织切片扫描成像系统显示小鼠耳廓皮肤中PGP 9.5阳性神经纤维与Phalloidin标记的血管的走行一致,均从耳廓的基部延伸至其外周区域,形成了耳廓的神经血管网络。虽然小鼠耳廓皮肤未经透明化处理前已接近半透明状态,但是其组织透光性仍较差(图1a1,a2),成像的清晰度和完整性均受到一定的限制(图1b1,b2)。相比而言,经组织透明化处理后,耳廓组织呈透明状(图1a3,a4),进一步增强神经和血管标记的可视化(图1b3,b4)。
在此基础上,激光扫描共聚焦显微镜下的高放大图重点观察耳廓皮肤中神经-血管伴行的空间分布特征(图2)。单纯用常规免疫荧光染色标记可显示神经纤维和血管两者的空间伴行关系(图2a,b),然而,作为比较,经组织透明化处理后,标记的神经纤维和血管具有更高的清晰度和完整性,可从耳廓皮肤的浅层到深层均捕获完整的荧光信号,成像深度可高达200 μm(图2c,d)。同时,利用Imaris图像处理系统重建的三维模式图同样证实经组织透明化处理的标本优于单纯的常规染色标本(图2a',b',c',d'及视频)。
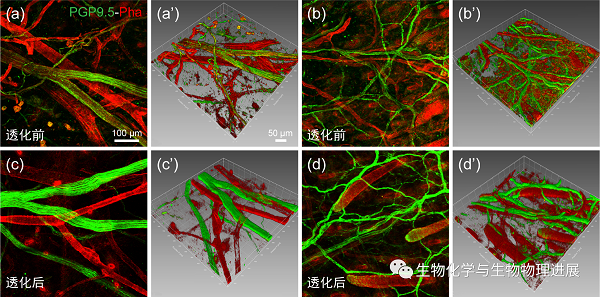
图2 小鼠耳廓皮肤中神经纤维和血管标记在经透明化处理前后的高倍对比图
以上描述了一种"免疫荧光染色+组织透明化+激光扫描共聚焦显微成像"的组织学研究新方案,对比以前单纯的传统组织学染色,在展示皮肤的整体神经血管网络方面具有明显优势,可获得从浅层至深层的神经纤维和血管的高分辨图像,并以三维模式呈现整体的神经血管网络。此方法增强了皮肤内神经和血管的可视化,为更深入了解其形态学细节提供了可能。作为一种改进的方案,可用于研究其他类型的厚组织和器官中神经纤维和血管的空间分布相关性。(详情请点击阅读原文)
各种组织透明化技术,包括疏水、亲水和基于水凝胶的方法,已经在组织学研究中流行起来。通过组织透明化处理,将脂质、色素和水从标本中去除,以减少光的散射,并允许光几乎不受限制地穿透完整的器官和整个生物样本来激发荧光。通过将组织透明化技术与光片显微镜和大型的自动图像分析系统相结合,许多研究已经取得了富有成效的结果[9-10]。即使是用普通荧光显微镜或激光扫描共聚焦显微镜,组织透明化也适合以三维模式分析整个耳廓皮肤内的神经和血管标记。然而,需要强调的是整体方案中Triton-X 100的浓度和抗体的孵育时间对整体的免疫荧光染色具有重要意义。
参考文献
[1] Navarro X, Verdú E, Wendelscafer-Crabb G, et al. Innervation of cutaneous structures in the mouse hind paw: a confocal microscopy immunohistochemical study. J Neurosci Res, 1995, 41(1): 111-120
[2] Bermejo P, López M, Larraya I, et al. Innervation of the human cavum conchae and auditory canal: anatomical basis for transcutaneous auricular nerve stimulation. Biomed Res Int, 2017, 2017: 7830919
[3] Cai R, Pan C, Ghasemigharagoz A, et al. Panoptic imaging of transparent mice reveals whole-body neuronal projections and skull-meninges connections. Nat Neurosci, 2019, 22(2): 317-327
[4] Ueda H R, Ertürk A, Chung K, et al. Tissue clearing and its applications in neuroscience. Nat Rev Neurosci, 2020, 21(2): 61-79
[5] Wang J, Xu D S, Cui J J, et al. A new approach for examining the neurovascular structure with phalloidin and calcitonin generelated peptide in the rat cranial dura mater. J Mol Histol, 2020, 51(5): 541-548
[6] Wang X Y, Shi J T, Cao W Y, et al. Demonstrating the hairy and glabrous skin innervation in a 3D pattern using multiple fluorescent staining and tissue-clearing approaches. J Vis Exp, 2022, 183: e63807
[7] Yamazaki T, Li W, Mukouyama Y S. Whole-mount confocal microscopy for adult ear skin: a model system to study neurovascular branching morphogenesis and immune cell distribution. J Vis Exp, 2018, 29(133): 57406
[8] Yamazaki T, Li W, Yang L, et al. Whole-mount adult ear skin imaging reveals defective neuro-vascular branching morphogenesis in obese and type 2 diabetic mouse models. Sci Rep, 2018, 8(1): 430
[9] Richardson D S, Lichtman J W. Clarifying tissue clearing. Cell, 2015, 162(2): 246-257
[10] Daeschler S C, Zhang J, Gordon T, et al. Optical tissue clearing enables rapid, precise and comprehensive assessment of three dimensional morphology in experimental nerve regeneration research. Neural Regen Res, 2022, 17(6): 1348-1356
作者简介
王佳:中国中医科学院针灸研究所腧穴结构研究室助理研究员。研究方向为针灸作用途径的可视化研究。
(作者:王佳)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: