第一株柯萨奇病毒(Coxsackievirus, CV)是从美国纽约柯萨奇镇的非麻痹型脊髓灰质炎患儿粪便中分离得到的,并因此命名。根据病毒在乳鼠细胞内的致病特点不同分为A和B两组,A组有23个血清型,能使新生乳鼠产生广泛性骨骼肌炎,导致弛缓性麻痹;B组分为6个血清型,引起新生乳鼠病变特征是局灶性肌炎、脑炎等。CV传播途径主要为粪-口途径,在春秋季流行,主要感染5岁以下婴幼儿。CV感染可引发手足口病、急性疱疹性咽峡炎、心肌炎、病毒性脑膜炎等多种感染性疾病,临床表现复杂多样。
CV属肠道病毒属,小核糖核酸病毒科,为无包膜的单股正链RNA(+ssRNA)病毒,病毒外壳呈20面体,立体对称,由32个壳粒组成,基因组全长约7400 bp,构成了病毒核心(图1) 。基因组结构由1个开放阅读框及2个非翻译区构成,可编码4种结构蛋白(VP1、VP2、VP3和VP4),主要负责病毒核衣壳的组装,其中VP1基因具有主要的中和抗原决定簇,是肠道病毒血清学分型的重要依据,以及7种非结构蛋白(2A、2B、2C、3A、3B、3C和3D),在病毒复制、细胞自噬和逃逸天然免疫中发挥了重要作用[1]。
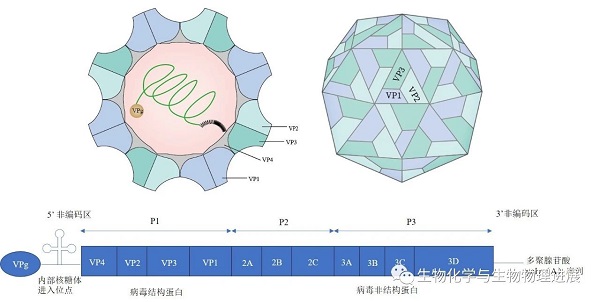
图1 CVB5结构模式图及基因组结构
CV与先天免疫应答
病毒的感染和宿主的免疫应答是一场博弈,其中天然免疫是维持机体内环境、平衡清除感染的病毒的第一步。一方面,病毒感染细胞后,其核酸开始复制和翻译,合成了具有酶活性的非结构蛋白,从而可阻断受体识别的信号通路,使病毒逃逸天然免疫应答[2]。如CVA16 3C蛋白与RIG-I N 端结构域结合,破坏与线粒体抗病毒信号蛋白之间的相互作用,抑制了IRF3的激活,从而导致IFN-Ⅰ信号被阻断[3-4](图2)。另一方面,病毒感染细胞后亦可造成宿主细胞中蛋白质或非编码RNAs的异常表达,进而影响宿主细胞的抗病毒先天免疫应答,调控自身病毒增殖。例如CVB3可通过上调MiR-146a负调控TLR3的表达,抑制先天免疫信号通路,促进自身病毒复制[5]。

图2 柯萨奇病毒与先天免疫应答
CV与自噬
同时,自噬也是一种能够抵御病毒入侵的免疫保护机制。自噬是一种细胞自发的、对外界侵入的异物进行吞噬、分解、最终消化吸收的过程。病毒入侵宿主细胞后,可引发细胞自噬。自噬体可将病毒蛋白包裹进自噬体内,通过与溶酶体融合发生降解,进而抑制病毒在细胞中的复制。例如,CVA16 2C蛋白促进自噬体积累,触发不完全自噬以增强自身复制[6]。同时,小RNA病毒也进化出自噬逃逸的方式,抑制自噬或诱发不完全自噬以促进自身病毒复制[7]。
CV与手足口病
手足口病是由肠道病毒感染引起的一种常见传染病,多发生于5岁以下婴幼儿,以发热和手足、口腔等部位皮疹、疱疹、溃疡为主要症状,少数患儿可引起无菌性脑膜炎、急性弛缓性麻痹、神经源性肺水肿和心肌炎等并发症,严重者甚至导致死亡。近年来在全球各地出现了爆发现象,重症率和死亡率均呈现上升趋势,对幼儿健康造成严重威胁,且造成巨大的经济损失[8]。手足口病是近些年婴幼儿常见的高发急性传染病,然而目前临床上仍以对症治疗为主,对其致病机制尚不明确,也缺乏抗病毒药物,因此深入开展抗病毒感染的免疫机制研究尤为重要。昆明理工大学医学院陈伟研究组以手足口病的重要病原体CVB5为研究对象,阐明了CVB5 3CD可抑制促炎因子和负调控NF-κB通路。同时,进一步通过STRING11.1数据库预测表明,CVB5 3CD与宿主多聚胞嘧啶结合蛋白1(PCBP1)蛋白具有相互作用,且PCBP1可促进IκBα和p65的磷酸化,抑制病毒复制。研究CVB5的非结构蛋白及其相互作用的靶蛋白,有助于探索病毒对细胞内天然免疫应答的调控作用,为研制抗病毒感染的药物提供作用靶点,同时为治疗手足口病毒感染引起的病毒性疾病奠定理论基础。(详情请点击阅读原文)
展望
柯萨奇病毒感染可引发多种病毒性感染性疾病,临床表现复杂多样,可引起手足口病、急性疱疹性咽峡炎、心肌炎、病毒性脑膜炎等疾病,且在全球范围内均有流行。其中,CVB5、CVA6、CVA10、CVA16为主要引发手足口病的病原体[9],CVB3为病毒性心肌炎的最常见病原体。柯萨奇病毒感染可诱发多种疾病,并且因其血清型众多,目前并未能制成有效可行的疫苗,也无相应的特效药上市。引发手足口病的重要病原体中,只有2016年肠道病毒71型灭活疫苗研制成功并获批上市,而针对柯萨奇病毒诱发的手足口病仍需科学家们更进一步的研究,因此深入研究柯萨奇病毒感染机制以及其同宿主细胞先天免疫之间的调控关系,将有助于人们对病原体的进一步了解及疫苗或预防性药物的研究。
参考文献
[1] Rezig D, Ben Yahia A, Ben Abdallah H, et al. Molecular characterization of coxsackievirus B5 isolates. J Med Virol, 2004, 72(2): 268-274
[2] Sun M, Lin Q, Wang C, et al. Enterovirus A71 2B inhibits interferon-activated JAK/STAT signaling by inducing caspase-3-dependent karyopherin-alpha1 degradation. Front Microbiol, 2021, 12: 762869
[3] Mukherjee A, Morosky S A, Delorme-Axford E, et al. The coxsackievirus B 3C protease cleaves MAVS and TRIF to attenuate host type I interferon and apoptotic signaling. PLoS Pathog, 2011, 7(3): e1001311
[4] Rui Y, Su J, Wang H, et al. Disruption of MDA5-mediated innate immune responses by the 3C proteins of Coxsackievirus A16, Coxsackievirus A6, and enterovirus D68. J Virol, 2017, 91(13): e00546-17
[5] Fei Y, Chaulagain A, Wang T, et al. MiR-146a down-regulates inflammatory response by targeting TLR3 and TRAF6 in Coxsackievirus B infection. RNA, 2020, 26(1): 91-100
[6] Shi Y, He X, Zhu G, et al. Coxsackievirus A16 elicits incomplete autophagy involving the mTOR and ERK pathways. PLoS One, 2015, 10(4): e0122109
[7] Mohamud Y, Qu J, Xue Y C, et al.CALCOCO2/NDP52 and SQSTM1/p62 differentially regulate coxsackievirus B3 propagation. Cell Death Differ, 2019, 26(6): 1062-1076
[8] Aswathyraj S, Arunkumar G, Alidjinou E K, et al. Hand, foot and mouth disease (HFMD): emerging epidemiology and the need for a vaccine strategy. Med Microbiol Immunol, 2016, 205(5): 397-407
[9] Esposito S, Principi N. Hand, foot and mouth disease: current knowledge on clinical manifestations, epidemiology, aetiology and prevention. Eur J Clin Microbiol Infect Dis, 2018, 37(3): 391-398
作者简介
张佳玉:昆明理工大学基础医学院细胞生物学研究生,研究方向为抗病毒免疫。
(作者:张佳玉)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: