免疫认知的传统分水岭:获得性免疫vs先天免疫
免疫系统是世界上几乎所有生物体为抵御微生物和寄生虫入侵的适应性机制。以往认为免疫是动物特有的功能性系统,随着对植物抗病,甚至细菌抗噬菌体入侵机制的阐明,现在的认知揭示免疫是一种十分重要、在进化上极其古老的生物学过程。
以人为代表,高等脊椎动物具有两套免疫机制。大家所熟悉的产生抗体的B淋巴细胞,攻击特定入侵微生物的T淋巴细胞等免疫功能属于获得性免疫,也就是在特定病原入侵机体后,通过刺激获得性免疫系统,扩增能抵御、消灭该特定病原的淋巴细胞,并且在后续同样病原入侵的情况下,初次感染的"记忆"通过预存的特异性获得性免疫淋巴细胞得以迅速发挥作用,有利于再次感染的情况下对该病原微生物更加有效的防御。
由于形成、扩增特异性获得性免疫淋巴细胞往往需要较长时间,获得性免疫具有"慢热"的特点。在新发病原入侵的情况下,如果仅仅依赖"慢热"的获得性免疫会给入侵的微生物快速繁殖的机会[1]。先天免疫是机体固有的非特异免疫拮抗机制,在感知病原入侵的"危险"信号的情况下,动物大部分细胞的免疫功能被激活,通过产生干扰素、抗菌肽等无差别杀伤分子,抑制病原微生物在机体内的繁殖。作为第一道免疫防线,先天免疫存在于几乎所有多细胞动物中, 而获得性免疫只是进化发生到高等脊椎动物后的近代创造。与慢热、精准的获得性免疫相比,先天免疫传统上被认为是较原始、简单、不具有记忆功能的免疫模式[2]。
如何准备应对新发病原引起的疫情
2019年末起席卷全球的新冠疫情,在造成全球经济和公共卫生极大破坏的同时,四年时间内造成超过7亿确诊病例,直接导致超过7百万生命的丧失[3]。特别是在疫情扩散的早期,在缺乏疫苗、有效中和抗体药物,以及抗新冠病毒小分子药物的情况下,大量重症和丧生于感染的人群是老年人等基础免疫力低下的人群。这提示我们,在新发疫情袭来时,需要准备好科学有效的应对方式,保护好这些对感染特别脆弱的群体。由于获得性免疫防御的建立依赖于被类似于病原的预感染或对应人工抗原的免疫接种,在无法预见引发疫情病原分子特征的情况下,在疫情之前或者传播的初期有效建立获得性免疫防御屏障无疑是十分困难的[4]。在这个前提下,能否有办法提升易感人群的先天免疫屏障,成为应对下一次新发病原疫情的核心挑战。然而,先天免疫由于无法通过特定免疫拮抗细胞的扩增来实现,在过去非常长的时间内也被认为无法像获得性免疫一样获得免疫记忆。这一认知在近年来被逐渐颠覆,成为现代免疫学的一个爆发点。
卡介苗引发的现代免疫学奇迹
卡介苗是一种减毒的结核杆菌,由法国疫苗学家阿尔贝·卡尔梅特和卡米尔·介兰制备,并最早用于肺结核的预防,在肺结核常见的国家中广泛使用。自1921年首次在人体接种卡介苗以来,每年全球约有1亿新生儿和4亿人接种,是人类历史上使用最多的疫苗。历来流行病学分析揭示接种卡介苗的受众发现,卡介苗不仅对结核的传播起到有效的阻遏作用,还有广谱的健康增进效力[5]。例如,在广泛接种了卡介苗的西非国家,卡介苗降低儿童死亡率达到50%以上,这一数字远远不能由预防结核病自身所能达到[6-7]。卡介苗减少的不仅仅是细菌引发的严重感染、对病毒引发的感染,也有众多保护性的报道[8]。例如,新冠疫情期间的流行病学统计揭示,在强制婴儿接种卡介苗的国家,新冠的重症率及致死率都比不强制接种卡介苗的同等国家低[9]。为何减毒的结核杆菌疫苗能呈现广谱、非特异性的免疫保护作用?这样的免疫学奇迹用特异性的获得性免疫无法解释。
后续利用动物模型对卡介苗的非特异保护机制进行过详尽的刨析,的确发现获得性免疫系统与该过程无关。例如,在胸腺切除(无T细胞)或获得性免疫缺失的小鼠中,卡介苗的非特异保护作用依然保留[10]。故事发展到此,谜底终于水落石出:是先天免疫系统在卡介苗弱毒性细菌感染接种后,获得了更强的活性,从而在动物的后续生命活动中,对其他病原微生物的入侵,呈现更优的拮抗作用。
卡介苗引发的现代免疫学奇迹,揭示了免疫系统的记忆特性,不仅仅局限于获得性免疫。由于先天免疫具有比获得性免疫更古老的发展历史,生命进化在先天免疫的演变过程中,或许早已选择性偏爱了能具备一定免疫记忆功能的个体繁衍至今。在脊椎动物中,除了卡介苗以外,其他微生物(例如白假丝酵母和疱疹病毒)感染均被发现具有广谱的抗感染保护作用 [11]。甚至不通过活病原微生物的感染,利用激活先天免疫的"危险"信号分子(如β葡聚糖),即可刺激免疫记忆的形成。已知的其作用的先天免疫细胞包括巨噬细胞与NK细胞。但是由于成熟的髓系细胞具有有限的寿命,通过这些细胞实现的记忆免疫功能无法具有长效。有报道,造血干细胞也可以被免疫激活,而其承载的免疫记忆能长期留存,并通过影响其细胞分化及分化细胞的免疫功能实现全面的免疫调节功能。近来也有通过靶向造血干细胞,刺激其形成免疫记忆,实现对体内癌细胞更有效杀伤的纳米免疫疗法报道[12]。
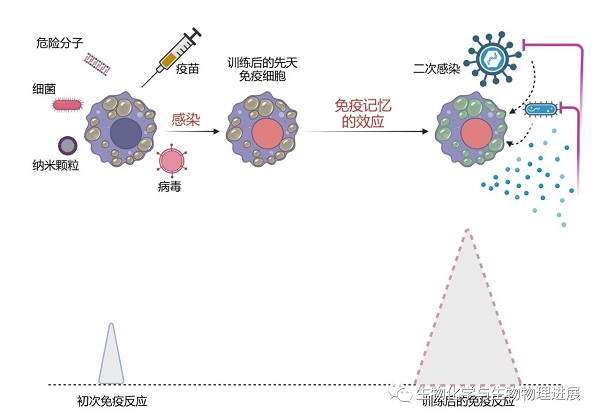
造就先天免疫的驯龙高手
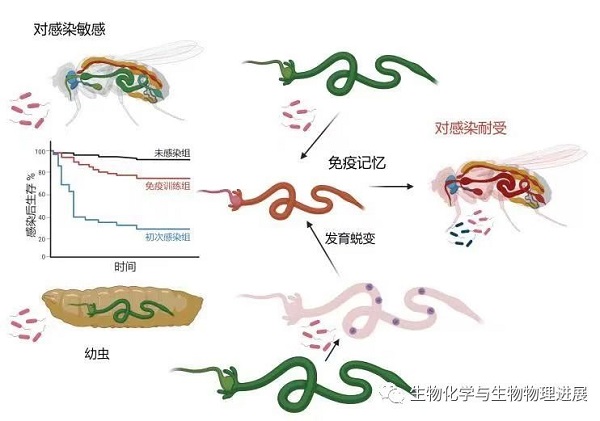
基于训练先天免疫系统免疫增效的发现,为我们通过加强先天免疫壁垒有效防御未知新发病原微生物提供了切实可行的策略与希望。但是,与获得性免疫增加特异性淋巴细胞的数量、不断演化更强效的特异性免疫识别分子的既有系统性认知相比,我们对先天免疫系统如何被有效训练,以及训练信息如何被特定细胞长期留存,并且在新的病原微生物感染时如何帮助先天免疫系统更好地被激活所知甚少。因此,需要寻找简单、易通过遗传操作来探究免疫记忆与功能存储的训练免疫模式系统,来开展系统性的研究工作。高等脊椎动物具有与人类似的生理特征,但是由于强大获得性免疫系统的存在使得剥离先天免疫系统在免疫记忆中的作用变得十分繁琐。无脊椎动物中也曾有大量训练免疫现象被报道,由于获得性免疫系统的缺失,使得免疫记忆容易被追溯到特定先天免疫细胞的获得性功能上[13]。其中,果蝇是经典的模式无脊椎动物,具有极其丰富的细胞生物学与遗传学操控工具,非常清楚的组织器官发育模式。最近,郑州大学彭颖教授团队的工作聚焦在果蝇的肠道上,利用通过口腔喂食侵染病原微生物,建立了非常简单可靠的训练免疫研究模型(详情请点击阅读原文)。他们用两种革兰氏阴性菌、胡萝卜软腐欧文氏菌及铜绿假单胞菌分别经口腔感染果蝇,在第一次感染完全消退后进行再次感染,研究发现果蝇肠道中获得了更为强大的训练免疫,可由同源或异源革兰氏阴性菌口腔感染引发,且免疫记忆可在整个发育阶段持续存在(详情请点击阅读原文)。果蝇肠道的细胞类型简单,并且与人的肠道干细胞分化为成熟的上皮细胞、黏液分泌细胞的基本范式高度一致。他们发现在初次感染后,果蝇肠道上皮细胞获得了更强的免疫屏障功能,在二次感染后更好地激活了大量先天免疫相关的IMD-Relish通路下游基因(详情请点击阅读原文)。肠道上皮细胞即可通过重编程,将以往的感染信息通过染色质重构,保存在先天免疫相关基因周围的染色质结构中。该研究发现,肠道干细胞自身可能也可以是免疫记忆的承载细胞,因为在幼虫阶段的感染记忆,可以表现在成虫阶段的免疫功能增强上,而在肠道中,干细胞是唯一能从幼虫保留到成虫阶段的细胞类型。课题组利用果蝇肠道的训练免疫模型,将进一步揭示感染免疫信号在刺激先天免疫的同时,如何将感染信息记录到响应的细胞内,从而调节后续潜在免疫效应的时程与强度。是否能通过人为靶向肠道上皮细胞或干细胞的特定染色质区域,重塑天然免疫的屏障功能?期待通过对果蝇模式生物的研究能最终走向临床,打造先天免疫的"驯龙高手"。
参考文献
[1] Murphy K, Weaver C. Janeway's Immunobiology, 9th edition, ISBN-13: 978-0815345503, Garland Science, 2016
[2] Melillo D, Marino R, Italiani P, et al. Innate immune memory in invertebrate metazoans: a critical appraisal. Front Immunol, 2018, 9: 1915
[3] WHO Coronavirus (COVID-19) Dashboard (https://covid19.who.int/)
[4] Mantovani A, Netea M G. Trained innate immunity, epigenetics, and Covid-19. N Engl J Med, 2020, 383(11): 1078-1080
[5] Chen J, Gao L, Wu X, et al. BCG-induced trained immunity: history, mechanisms and potential applications. J Transl Med, 2023, 21(1): 106
[6] Garly M L, Martins C L, Bale C, et al. BCG scar and positive tuberculin reaction associated with reduced child mortality in West Africa. A non-specific beneficial effect of BCG?. Vaccine, 2003, 21(21-22): 2782-2790
[7] Kristensen I, Aaby P, Jensen H. Routine vaccinations and child survival: follow up study in Guinea-Bissau, West Africa. BMJ, 2000, 321(7274): 1435-1438
[8] Moorlag S J C F M, Arts R J W, van Crevel R, et al. Non-specific effects of BCG vaccine on viral infections. Clin Microbiol Infect, 2019, 25(12): 1473-1478
[9] Miller A, Reandelar M J, Fasciglione K, et al. Correlation between universal BCG vaccination policy and reduced mortality for COVID-19. MedRxiv, 2020, doi: https://doi.org/10.1101/2020.03.24.20042937
[10] Kleinnijenhuis J, Quintin J, Preijers F, et al. Bacille Calmette-Guerin induces NOD2-dependent nonspecific protection from reinfection via epigenetic reprogramming of monocytes. Proc Natl Acad Sci USA, 2012, 109(43): 17537-17542
[11] Netea M G, Joosten L A, Latz E, et al. Trained immunity: a program of innate immune memory in health and disease. Science, 2016, 352(6284): aaf1098
[12] Priem B, van Leent M M T, Teunissen A J P, et al. Trained immunity-promoting nanobiologic therapy suppresses tumor growth and potentiates checkpoint inhibition. Cell, 2020, 183(3): 786-801
[13] Lanz-Mendoza H, Contreras-Garduño J. Innate immune memory in invertebrates: concept and potential mechanisms. Dev Comp Immunol, 2022, 127: 104285
作者简介
彭颖:生物物理与结构生物学博士,郑州大学学科特聘教授,郑州大学第五附属医院客座教授,郑州大学感染免疫研究所所长。研究方向为细胞染色质结构与表观遗传学调控, 冠状病毒复制包装的细胞生物学, 肿瘤的细胞命运决定与免疫干预。
(作者:彭颖)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: