众所周知,人体由多种组织器官组成,按功能差异可分为不同的器官功能系统,如运动系统、呼吸系统、消化系统、神经系统、免疫系统等,各个系统之间各司其职又相互作用,共同维持机体的健康和稳态。其中,免疫系统作为机体的"军队和警察",能够采用各种不同斗争形式--免疫应答,发挥免疫防御、免疫监视和免疫自稳功能。防御即对外防止各种病原体如细菌、病毒、真菌及其他有害物质的入侵,可通过多种方式来完成,包括产生抗体、激活免疫细胞、释放细胞因子等;监视即对内随时发现和清除体内出现的"非己"成分,如由基因突变而产生的肿瘤细胞以及衰老、死亡细胞等;自稳指免疫系统有区分"自己"和"非己"的能力,正常情况下只对"非己"进行斗争,而不干扰自身正常组织细胞的生存和功能发挥,通过免疫耐受和免疫调节来达到机体内环境的稳定。
如同军队打仗需要不同兵种协同作战一样,免疫系统发挥各种免疫功能也是由不同免疫细胞相互作用完成,针对不同的敌人--抗原,免疫系统不但可以针对性地产生不同细胞亚群来进行对抗,而且还能通过彼此之间的信息交流进行分工协作。有些免疫细胞主要负责在前线奋勇杀敌,而有些免疫细胞则主要负责在后方指挥调节。其中,目前已知最重要的"指挥调节者"是CD4+T细胞。
CD4+T细胞是由胸腺产生的淋巴细胞亚群,在免疫应答过程中扮演重要角色。特别是在细胞介导免疫(cell-mediated immunity)中,CD4+T细胞主要识别由抗原提呈细胞(antigen-presenting cell, APC)提呈的外来抗原并产生响应。这个响应可以调节其他免疫细胞,如B细胞或者CD8+T细胞的活动,也可以启动新的免疫反应。这些功能的产生主要通过两个步骤--活化和分化来完成。
CD4+T细胞的活化和分化是指幼稚T细胞接受某些信号,增殖并获得功能分化。CD4+T细胞活化需要两个信号。首先,在CD4共受体和T细胞受体(TCR)-CD3复合物存在下,TCR识别抗原MHC II复合体,允许信号的传递。在TCR与MHC II复合体结合的情况下,APCs表面的共刺激分子与T细胞表面配体结合,构成了第二信号。这两个信号允许T淋巴细胞的存活和增殖,但不足以获得功能分化[1]。第三个信号,由微环境中细胞分泌的细胞因子提供,并与TCR共同决定CD4+T淋巴细胞的命运。
CD4+T细胞的分化
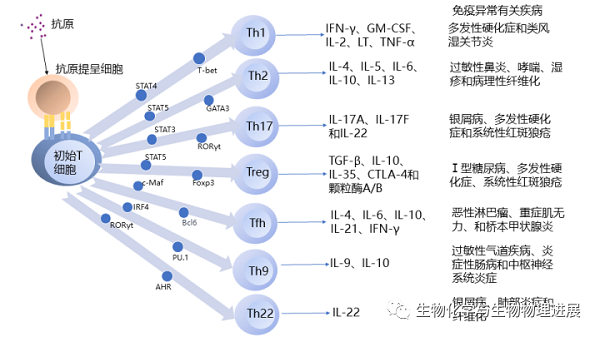
CD4+T细胞分化产生辅助T细胞1(Th1)、Th2、Th17和调节性T细胞(Treg)等多种亚群。最初,研究者根据其分泌物和功能将CD4+T细胞细分为两个不同的群体Th1和Th2[2]。Th1通常由来自于细胞内寄生的病原体如细菌、病毒等刺激分化产生,分泌干扰素γ(IFN-γ)、粒细胞巨噬细胞集落刺激因子(GM-CSF)等。Th1细胞通过释放细胞因子,特别是IFN-γ,来增强宿主细胞的抗感染能力,也能够激活巨噬细胞,增强它们的吞噬和杀伤能力,促进病原体的清除,发挥防御功能。Th1细胞可以识别并激活其他免疫细胞,如细胞毒性T淋巴细胞(CTL),来消灭这些异常细胞,从而起到监视和抑制肿瘤细胞或衰老、死亡细胞的作用。Th1细胞还在免疫系统中发挥自稳作用,通过产生一系列的细胞因子影响其他类型的T细胞、B细胞和抗体的产生,调节整个免疫反应的规模和持续时间,维持内环境的稳定。Th2通常被胞外菌及其释放的内外毒素和寄生虫等抗原刺激分化,分泌IL-4、IL-5等细胞因子。Th2细胞主要参与体液免疫应答,通过细胞因子可以激活B细胞,促进B细胞分化为抗体产生细胞(浆细胞),产生特异性抗体,发挥防御功能。Th2细胞分泌细胞因子维持一定数量的Th2细胞,维持体液免疫的稳定性。
Th17因其分泌的因子得名Th17[3]。其标志性细胞因子为IL-17。这些细胞因子能够吸引和激活其他免疫细胞,如中性粒细胞和巨噬细胞,增强它们对细菌和真菌的清除能力,还能维持消化道等上皮免疫屏障的完整性,保持其防御功能,也能促进肿瘤内免疫细胞的募集,具有抗肿瘤功能。Th17可以识别和监视机体中的组织损伤和炎症情况,引导炎症反应和组织修复过程。Th17细胞与其他免疫细胞之间存在相互作用与调控关系,也可通过自身调节来维持免疫系统的平衡。
Treg于1995年被发现,标志为CD3+CD4+CD25+Fox-p3+[4]。Treg细胞主要分泌TGF-β、IL-10等,具有免疫抑制功能。Treg细胞主要参与免疫耐受和免疫调节,确保免疫系统对外来抗原做出适当的应答,也避免过度的免疫反应导致自身免疫病和过度炎症反应,维持免疫系统对自身组织的耐受性,有助于细胞或器官移植。
Tfh定位于淋巴滤泡中,分泌IL-4、IL-6等细胞因子,参与次级淋巴滤泡(follicular)的生成;辅助B细胞分化为浆细胞,合成和分泌足够高亲和力的抗体,诱导或阻止Ig类别切换,促进抗体对病毒、细菌、寄生虫和真菌感染的反应,协助免疫记忆建立[5]。CD4+T细胞还会分化为Th9、Th22和Th3等。Th9细胞通过分泌IL-9介导蠕虫寄生虫免疫的启动,并具有有效抗肿瘤免疫的能力。Th22分泌IL-22,主要针对皮肤、消化和呼吸系统组织以及肾脏和关节等屏障表面的细胞,消除侵袭的病原体。

免疫应答是一把双刃剑,作为免疫应答主要调节者的CD4+T细胞也具有此特点。Th1过度激活可能导致炎症和自身免疫性疾病,如多发性硬化症(MS)和类风湿关节炎(RA)。同样地,过度活化的Th2细胞会促使过敏性疾病(如过敏性鼻炎、哮喘、湿疹)的发生,也会诱导不受控制的组织修复进而促进各种器官系统病理性纤维化的发展。Th17细胞参与许多自身免疫性疾病的发生,如银屑病、多发性硬化症和系统性红斑狼疮等。Treg细胞的过度增加或异常活化,能抑制正常的免疫应答,削弱对病原体的抵抗能力。Treg细胞功能异常或减少可能破坏免疫耐受,导致自身免疫病的发生或加重。Treg也通过诱导无能和免疫抑制导致肿瘤逃逸。Tfh细胞数量和活性增加,可能诱导自身免疫或低质量抗体反应。在获得性免疫缺陷综合征中,Tfh细胞可以成为艾滋病毒的储存库[6]。Th9会促进过敏性气道疾病、炎症性肠病和中枢神经系统炎症,进而导致自身免疫病的发生[7]。Th22可分泌IL-22与IL-17协同促进银屑病、肺部炎症和纤维化,也可能与系统性硬化症患者皮肤和内脏纤维化有关。
CD4+T细胞分化的调控
CD4+T细胞分化的过程受到多种因素的调控,其中包括抗原特异性刺激、T细胞受体、细胞因子、转录因子等。首先,当免疫系统检测到"非己"或异常物质存在时,抗原被呈递给CD4+T细胞的TCR。这是CD4+T细胞分化的起点。抗原种类使抗原被不同类型的抗原呈递细胞所呈递。抗原亲和力和数量诱导不同性质和不同强度的TCR信号。TCR的第一信号和抗原呈递细胞共刺激分子的第二信号相互作用,共同调控CD4+T细胞的活化和分化。
其次,由抗原提呈细胞和已分化CD4+T细胞分泌的细胞因子对CD4+T细胞分化的调控也起着关键作用。IL-12和IFNγ是Th1分化的两种重要细胞因子。IL-12通过激活STAT4诱导Th1细胞分化,IFN-γ也通过激活STAT1促进Th1细胞分化。Th2细胞分化是被IL-4通过激活STAT6诱导的,IL-2介导的STAT5活化也可发挥作用。IL-2介导的STAT5还能与TGF-β联合诱导Treg分化。因此,细胞因子主要是通过影响STAT转录因子家族,影响主转录因子,进而调控CD4+T细胞分化。
最后,主转录因子在响应特定细胞因子信号和细胞环境的调控下,通过激活特定基因表达模式,帮助塑造和维持免疫系统的平衡和功能多样性。每种细胞亚群主转录因子不同,被称为谱系特异性主转录因子。T-bet是Th1细胞分化的主要转录因子,促进Th1细胞特定基因的表达,如IFN-γ和IL-12受体β2链,并抑制其他亚群特定的基因表达。GATA结合蛋白3(GATA3)是Th2细胞分化的主转录因子,可以直接与不同区域的IL-4/IL-13基因位点结合,也可以通过与IL-5和IL-13 基因的启动子结合诱导IL-5和IL-13转录。类核受体超家族转录因子(RORγt)是Th17细胞分化的主转录因子,直接调控IL-17A和IL-17F的表达。RORγt表达的诱导取决于IL-6、IL-21和/或IL-23介导的STAT3激活[8]。叉头框蛋白P3(Foxp3)是Treg分化的主转录因子,促进Treg细胞特定基因的表达,如CTLA-4和IL-10。这些主转录因子也存在交叉调控,比如T-bet的过表达抑制GATA3转录,并通过直接的蛋白质-蛋白质相互作用抑制GATA3功能[9]。总的来说,Th谱系的基本转录因子分别是T-bet/STAT4(Th1)、GATA3/STAT5(Th2)、RORγt/STAT3(Th17)和Foxp3/STAT5(Treg)。
表观遗传修饰在CD4+T细胞分化过程中也发挥着重要作用,通过调控染色质结构和基因可及性来调控表达。谱系特异性转录因子通过直接结合和伴随关键基因位点的表观遗传沉默来抑制其他谱系特异性程序。比如,Th2细胞转录因子GATA3和STAT6靶向IFN-γ启动子,这与多梳抑制复合物1(PRC1)和组蛋白H27中的第3个氨基酸(H3K27)甲基转移酶EZH2与IFN-γ位点的结合相关,导致Th1细胞代表性细胞因子受到抑制。
表观遗传修饰也与细胞可塑性有关。一些标志性位点一度可以被视为稳定和可遗传的特征,但后来发现Th17细胞可以产生IFN-γ,这是Th1细胞的标志性细胞因子[10];Treg细胞可以产生IL-17[11]。而这样的改变被认为是CD4+T细胞的可塑性。这种可塑性来源于表观遗传修饰。这种修饰被称为"二价修饰",即同时表达抑制性和活性组蛋白标记的染色质区域,通常分别对应H3K27三甲基化( H3K27me3 )和 H3K4me3 修饰。二价修饰保留了在不产生某细胞因子的CD4+T细胞中产生该细胞因子的可能性,使细胞对该细胞因子具有一定的可塑性[12]。(请点击阅读原文了解组蛋白去乙酰化酶对外周CD4+T细胞分化的影响)
展望
CD4+T细胞是免疫系统的主要"调节者",研究CD4+T细胞分化有助于深入了解免疫系统的调节机制以及其在疾病发展中的作用。研究CD4+T细胞分化,我们可以了解不同亚群的异常分化和功能,探究CD4+T细胞分化对自身免疫疾病的影响,并寻找新的治疗策略来调节CD4+T细胞的免疫应答。我们也可以根据研究,开发针对疾病的治疗策略,预防过敏性疾病、器官纤维化,还可以为精准医学提供指导。表观遗传学对细胞可塑性调节和先天淋巴细胞的研究,为免疫治疗策略的开发提供了新的应用方向[13]。
参考文献
[1]Chalmin F, Humblin E, Ghiringhelli F, et al. Transcriptional programs underlying Cd4 T cell differentiation and functions. Int Rev Cell Mol Biol, 2018, 341: 1-61
[2]Mosmann T R, Cherwinski H, Bond M W, et al. Two types of murine helper T cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins. J Immunol, 1986, 136(7): 2348-2357
[3]Park H, Li Z, Yang X O, et al. A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17. Nat Immunol, 2005, 6(11): 1133-1141
[4]Fantini M C, Becker C, Monteleone G, et al. Cutting edge: TGF-beta induces a regulatory phenotype in CD4+CD25- T cells through Foxp3 induction and down-regulation of Smad7. J Immunol, 2004, 172(9): 5149-5153
[5]King C, Tangye S G, Mackay C R. T follicular helper (TFH) cells in normal and dysregulated immune responses. Annu Rev Immunol, 2008, 26: 741-766
[6]Hong J J, Amancha P K, Rogers K, et al. Spatial alterations between CD4(+) T follicular helper, B, and CD8(+) T cells during simian immunodeficiency virus infection: T/B cell homeostasis, activation, and potential mechanism for viral escape. J Immunol, 2012, 188(7): 3247-3256
[7]Froidure A, Shen C, Gras D, et al. Myeloid dendritic cells are primed in allergic asthma for thymic stromal lymphopoietin-mediated induction of Th2 and Th9 responses. Allergy, 2014, 69(8): 1068-1076
[8]Zhu J, Paul W E. CD4 T cells: fates, functions, and faults. Blood, 2008, 112(5): 1557-1569
[9]Hwang E S, Szabo S J, Schwartzberg P L, et al. T helper cell fate specified by kinase-mediated interaction of T-bet with GATA-3. Science, 2005, 307(5708): 430-433
[10]Harrington L E, Hatton R D, Mangan P R, et al. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages. Nat Immunol, 2005, 6(11): 1123-1132
[11]Xu L, Kitani A, Fuss I, et al. Cutting edge: regulatory T cells induce CD4+CD25-Foxp3- T cells or are self-induced to become Th17 cells in the absence of exogenous TGF-beta. J Immunol, 2007, 178(11): 6725-6729
[12]Wei G, Wei L, Zhu J, et al. Global mapping of H3K4me3 and H3K27me3 reveals specificity and plasticity in lineage fate determination of differentiating CD4+ T cells. Immunity, 2009, 30(1): 155-167
[13]Artis D, Spits H. The biology of innate lymphoid cells. Nature, 2015, 517(7534): 293-301
作者简介
许帆:华北理工大学基础医学院免疫学硕士研究生,研究方向为组蛋白去乙酰化对免疫系统的影响。
郑全辉:华北理工大学免疫学系教授。研究方向为T细胞发育分化的表观遗传调控研究。
(作者:许帆、郑全辉)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: