人类利用电刺激来治疗疾病的方法可以追溯到远古时期,那时候虽然人类对于电的本质一无所知,但已经利用鳐鱼等动物所产生的电来缓解头痛病。当人与鳐鱼共处于同一水池之中时,就会遭受鳐鱼产生的数十至数百伏脉冲的电击,可以调节人体神经系统的活动。如今,神经调控已广泛用于临床,治疗各种神经系统疾病。例如图1所示,脊髓电刺激用于治疗慢性疼痛,骶神经电刺激用于治疗膀胱排尿功能障碍,迷走神经电刺激用于治疗药物难治性癫痫等[1-4]。还有治疗失聪的人工耳蜗、改善睡眠呼吸暂停的舌下神经刺激以及恢复残障肢体功能的功能性神经电刺激等[5-7]。这些方法的共同特点是,都施加电刺激于神经纤维,也就是神经元的轴突。通过诱导轴突上的电活动来调控神经元活动及其控制的肌肉活动。
深部脑刺激(deep brain stimulation,DBS)是另一种发展迅速的神经调控方法,也被称为脑起搏器。目前在临床上主要用于治疗帕金森病等运动障碍的神经系统疾病,也已获得美国食品药品监督管理局(FDA)批准用于治疗难治性癫痫[8-9]。此外,它在控制毒品成瘾、顽固性强迫症等精神疾病方面也展现出良好的应用前景[9]。甚至在治疗智力障碍、改善脑的记忆功能、唤醒脑的植物状态等方面也获得了令人瞩目的研究成果[10-11]。与前述几种方法有所不同的是,DBS是将细电极针植入至深部脑区(如丘脑底核、海马等),以激活电极周围的神经元。虽然它的刺激目标并非轴突,但轴突的兴奋在DBS中也起着关键作用[12]。

图1 电刺激神经调控示例(图改自[4, 13])
红色方框内为电刺激部位
深部脑刺激中的轴突电活动
DBS通过电极施加的是窄脉冲的高频电刺激(high-frequency stimulation,HFS),脉冲频率为100 Hz左右,脉宽仅为0.1 ms左右。对于电极周围的神经元各种组成结构,如胞体、轴突和树突等,由于它们的形状和细胞膜特性不同,DBS所采用的窄脉冲会优先激活轴突[14-15],而不是胞体等其他结构。在轴突上诱发的动作电位,会沿轴突传导出去,进而调控神经网络的活动。因此,轴突的兴奋在DBS中具有重要作用[12]。
如图2所示,在细胞外空间施加单个阈上强度的电脉冲刺激时,可以兴奋轴突并诱发其产生动作电位。兴奋区电流(即钠离子流)由膜外流向膜内,在胞外形成“电流穴”。在电位差驱动下,两侧的非兴奋区电流由膜内流向膜外,在胞外形成“电流源”,并使得非兴奋区去极化,进而导致动作电位沿轴突向两侧传导。其中,传向轴突末梢的称为顺向传导,可以调控下游突触后神经元的活动;传向神经元自身胞体的称为逆向传导,可以调控胞体活动。
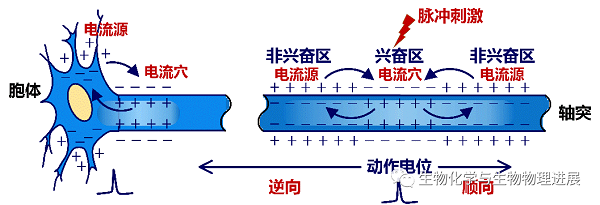
图2 轴突上动作电位的产生与传导
在理想情况下,每施加一个电脉冲,就可以诱发轴突产生一个动作电位,并顺利传导出去。但是,在HFS的持续脉冲作用下,轴突会逐渐出现去极化阻滞[16-18],造成两种效应:一是轴突不能跟随HFS的每个脉冲,只能间歇地跟随部分脉冲产生动作电位;二是刺激区产生的动作电位不能百分百成功地传导出去(图3)。因此,在持续HFS期间,轴突上产生并传导至胞体的动作电位频率低于脉冲频率。那么,在这种轴突阻滞的情况下,HFS的作用是否会引起胞体的变化?
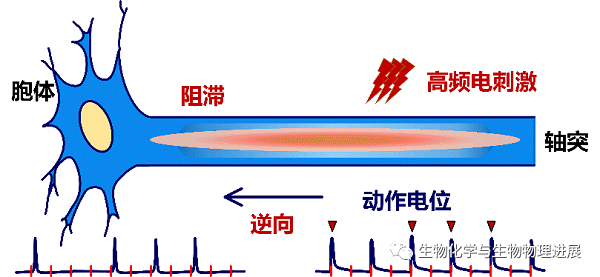
图3 持续高频电刺激(HFS)引起轴突阻滞
下方膜电位信号上的红色短竖线表示频率为100 Hz的脉冲刺激,红色倒三角表示受刺激部位产生的能够成功传导至胞体的动作电位。
持续轴突高频电刺激对胞体的影响
浙江大学生物医学工程与仪器科学学院封洲燕团队利用电流源密度(current source density,CSD)分析法,考察HFS期间轴突兴奋逆向传导至胞体附近时动作电位产生和传导的变化(图4,详情请点击阅读原文)。CSD利用胞外记录的局部场电位来估计跨膜电流变化,可以反映电流源和电流穴及其大小。CSD电流穴指示动作电位产生的部位(图2),电流穴的传导速度即为动作电位的传导速度(图4)。
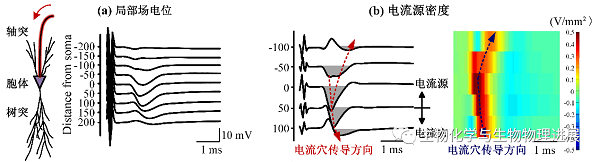
图4 轴突兴奋逆向传导至神经元胞体附近时产生的局部场电位与电流源密度
CSD分析的结果表明,在持续的轴突HFS期间,胞体附近CSD电流穴的传导速度变小,即动作电位的传导速度变慢(图5)。这说明,虽然直接受HFS作用的是轴突,且轴突阻滞已经削减了HFS对于胞体的兴奋作用,但是胞体的状态仍然会发生改变。
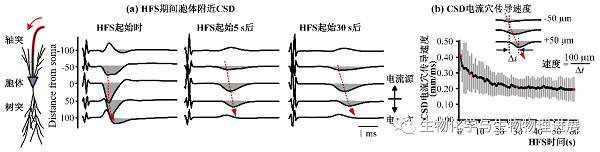
图5 持续HFS期间胞体附近CSD电流穴的传导速度变慢
结语
许多依赖于轴突电活动发挥作用的电刺激神经调控方法已经用于临床治疗与实验研究。然而,轴突电刺激,尤其是脑内神经元的轴突高频电刺激的作用机制尚未完全清楚,限制了神经调控技术的发展和推广应用。封洲燕团队利用海马脑区的层状结构和CSD分析法,发现大鼠海马CA1区锥体神经元轴突上的持续高频电脉冲刺激,在导致轴突阻滞的情况下,仍然会影响胞体的活动状态,减慢胞体对于顺向和逆向激活的响应速度。此发现有助于深入了解DBS的作用机制,并为研究刺激后效应以及开发新型电刺激模式提供依据。
参考文献
[1] Ben-Menachem E, Manon-Espaillat R, Ristanovic R, et al. Vagus nerve stimulation for treatment of partial seizures: 1. A controlled study of effect on seizures. First International Vagus Nerve Stimulation Study Group. Epilepsia, 1994, 35(3): 616-626
[2] Knowles C H, de Wachter S, Engelberg S, et al. The science behind programming algorithms for sacral neuromodulation. Colorectal Dis, 2021, 23(3): 592-602
[3] Lam C M, Latif U, Sack A, et al. Advances in spinal cord stimulation. Bioengineering (Basel), 2023, 10(2): 185
[4] Padilla-Fernandez B, Hernandez-Hernandez D, Castro-Diaz D M. Current role of neuromodulation in bladder pain syndrome/interstitial cystitis. Ther Adv Urol, 2022, 14: 17562872221135941
[5] Mashaqi S, Patel S I, Combs D, et al. The hypoglossal nerve stimulation as a novel therapy for treating obstructive sleep apnea-A literature review. Int J Environ Res Public Health, 2021, 18(4): 1642
[6] Gay R D, Enke Y L, Kirk J R, et al. Therapeutics for hearing preservation and improvement of patient outcomes in cochlear implantation-Progress and possibilities. Hear Res, 2022, 426: 108637
[7] Juckett L, Saffari T M, Ormseth B, et al. The effect of electrical stimulation on nerve regeneration following peripheral nerve injury. Biomolecules, 2022, 12(12): 1856
[8] Benabid A L, Pollak P, Louveau A, et al. Combined (thalamotomy and stimulation) stereotactic surgery of the VIM thalamic nucleus for bilateral Parkinson disease. Appl Neurophysiol, 1987, 50(1-6): 344-346
[9] Lee D J, Lozano C S, Dallapiazza R F, et al. Current and future directions of deep brain stimulation for neurological and psychiatric disorders. J Neurosurg, 2019, 131(2): 333-342
[10] Faillot M, Chaillet A, Palfi S, et al. Rodent models used in preclinical studies of deep brain stimulation to rescue memory deficits. Neurosci Biobehav Rev, 2021, 130: 410-432
[11] Arnts H, Tewarie P, van Erp W S, et al. Clinical and neurophysiological effects of central thalamic deep brain stimulation in the minimally conscious state after severe brain injury. Sci Rep, 2022, 12(1): 12932
[12] 封洲燕, 郭哲杉, 王兆祥. 深部脑刺激作用机制的研究进展. 生物化学与生物物理进展, 2018, 45(12): 1197-1203
[13] Lundstrom B N, Osman G M, Starnes K, et al. Emerging approaches in neurostimulation for epilepsy. Curr Opin Neurol, 2023, 36(2): 69-76
[14] Ranck J J. Which elements are excited in electrical stimulation of mammalian central nervous system: a review. Brain Res, 1975, 98(3): 417-440
[15] Nowak L G, Bullier J. Axons, but not cell bodies, are activated by electrical stimulation in cortical gray matter. II. Evidence from selective inactivation of cell bodies and axon initial segments. Exp Brain Res, 1998, 118(4): 489-500
[16] Zheng F, Lammert K, Nixdorf-Bergweiler B E, et al. Axonal failure during high frequency stimulation of rat subthalamic nucleus. J Physiol, 2011, 589(Pt 11): 2781-2793
[17] Jensen A L, Durand D M. High frequency stimulation can block axonal conduction. Exp Neurology 2009, 220(1): 57-70
[18] Feng Z, Zheng X, Yu Y, et al, Functional disconnection of axonal fibers generated by high frequency stimulation in the hippocampal CA1 region in-vivo. Brain Res, 2013, 1509: 32-42
作者简介
袁月:浙江大学生物医学工程与仪器科学学院博士研究生,研究方向为神经工程和深部脑刺激。
封洲燕:浙江大学生物医学工程与仪器科学学院教授、博士生导师,研究方向为生物医学信号处理和神经工程。
(作者:袁月、封洲燕)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: