在你的细胞里,可能每天上演着寻找、碰撞,进而"牵手成功"的故事。
维持细胞功能和正常发育过程中,调控基因转录过程起到关键作用,其中有两种扮演着重要角色的元件,即增强子、启动子。它们需要通力合作,才能起到"1+1>2"的效果。启动子好比一位才华横溢的大作家,但下笔总缺少灵感的触发,而增强子则是这位作家的专属"缪斯(灵感与艺术的女神)",恰好能激活源源不断的灵感。两种元件的相互作用决定基因的时空表达特异性,不仅参与了细胞命运的决定,还在多种疾病的发生发展中起到重要作用。然而,人类基因组中含有数十万个增强子和数万个启动子,"大作家"和自己的"缪斯"如何在茫茫人海中精准选择和配对彼此,这背后的特异性却不为人知。
7月12日,中国科学院生物物理研究所薛愿超团队在国际期刊Nature发表研究论文。他们使用一种特殊的"放大镜",揭示了增强子和启动子配对的秘密。
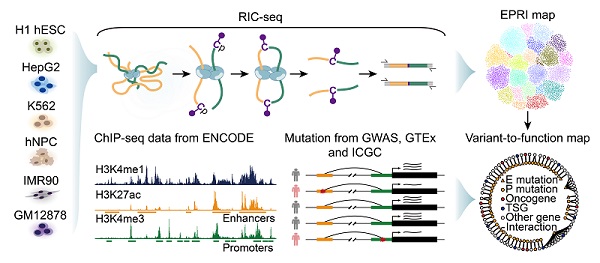
研究人员将目光投向了一种名为Alu的基因组重复序列,这是哺乳动物尤其是人类基因组中广泛分布的重复元件,恰好在增强子、启动子发生相互作用的位点高度富集。过去,Alu在基因转录调控中的作用还不清楚,而传统技术手段也无法观察到其中的相互作用。
当研究人员通过CRISPR-Cas9系统,分别敲除增强子区和启动子区的Alu元件,很快观察到神奇的现象:"作家"和"缪斯"不再能发生显著的相互作用,即增强子和启动子之间的空间邻近接触显著减少,靶标启动子对应基因的转录水平显著下调。而在原本不含有Alu元件的启动子区人为插入该元件,"作家"与"缪斯"果然能发生奇妙的反应,原本不受调控的基因会被激活,并且该启动子与增强子的空间接触也显著增加。这意味着,研究人员不仅揭示了Alu在基因表达调控中的新机制,还为理解增强子和启动子非编码RNA在转录激活的功能提供了新视角。

薛愿超团队发表Nature研究论文
那么,这项研究的意义该如何理解呢?
浩瀚的人类基因组序列,只有不到2%的序列能编码蛋白质。这意味着,绝大部分的DNA序列功能是未知的。最初,科学家们习惯地把这部分DNA统称为"垃圾"DNA,但随着研究的深入,人们意识到神秘的DNA"暗物质"自有迷人之处:它们的转录调控在维持细胞功能和正常发育过程中起着关键作用。
要知道,人类基因组大规模测序和关联研究表明,约90%与疾病相关的突变位于增强子和启动子等非编码区域,但是这些非编码突变的致病机理是什么,一直是困扰科学界多年的谜题。如果能破解增强子和启动子的联动密码,就能为理解疾病发生发展提供新范式。
研究人员将非编码区突变映射到增强子-启动子RNA互作(EPRI)图谱,发现有超过53万个突变落在启动子和增强子RNA相互作用位点,提示这些突变可能破坏EPRI导致基因转录异常,从而引发疾病。因此,该研究团队在EPRI图谱的基础上构建了"突变-功能"图谱,系统地注释了非编码突变可能影响的靶标基因,为理解疾病发生的潜在机制提供了宝贵的资源。
"增强子-启动子互作图谱"以及"突变-功能图谱"构建
这项发现背后的秘密武器,就是薛愿超团队开发的RNA原位构象测序技术RIC-seq。
过去,这类研究通常采用传统的染色质构象捕获技术,如Hi-C、HiChIP、ChIA-PET等。与最新研发的RIC-seq技术相比,Hi-C等传统技术更为"粗线条",只能测量大片段与大片段基因组的相互作用,很难发现更高分辨率下的序列特征,以及具体位点之间的相互作用。而RIC-seq技术可直接鉴定增强子和启动子非编码RNA之间的空间互作位点,并据此推导增强子-启动子的链接网络,因此在解析增强子-启动子互作的序列特征方面具有更高的分辨率。
2020年,薛愿超团队开发了RIC-seq技术,这项技术相当于一个更敏锐、更清晰的"放大镜",能够在不破坏细胞结构、保持细胞完整的情况下,原位处理胞内RNA,捕获生理状态下RNA分子内和分子间的相互作用。这项技术不仅能检测RNA的高级结构,而且可准确鉴定各类非编码RNA的作用靶标,这为后续深入研究非编码RNA所携带的"结构密码"及其功能提供了全新的实验工具。此外,该技术在病毒RNA的结构和靶标研究方面也有广阔的应用前景,新冠病毒、艾滋病病毒、埃博拉病毒、禽流感病毒等均属于RNA病毒,它们严重会威胁人类的生命健康。利用RIC-seq能够深入研究这些病毒的RNA结构和靶标,为预防和治疗相关疾病提供重要的科学支持。
更为重要的是,这是一项中国人自主研发的技术。这项捕获RNA原位高级结构及相互作用的技术由我国生物物理研究所原创,发明人包括薛愿超等,此项技术已获国家发明专利。目前,这项技术正在全球范围内实施成果转化,让人类在DNA"暗物质"的探索中看得更远。
相关论文信息:
https://doi.org/10.1038/s41586-023-06323-x
https://doi.org/10.1038/s41586-020-2249-1
(记者 李晨阳 见习记者 孟凌霄)
 附件下载:
附件下载: