巨噬细胞是固有免疫系统中最重要的免疫细胞之一,具有多样性,其广泛分布于机体的各种组织和体腔中(如腹腔巨噬细胞),是启动固有免疫反应的重要细胞。组织定居的巨噬细胞不仅具有强大的吞噬功能,吞噬并杀伤细菌等病原体,而且作为抗原提呈细胞,具有较强的摄取和处理抗原的能力,是联系适应性免疫和固有免疫的重要纽带[1]。腹腔巨噬细胞(peritoneal macrophage)主要维持腹腔免疫稳态,有研究报道,在各种炎症活性物质或感染性微生物刺激后,腹腔稳态失衡,此时腹腔巨噬细胞由于各种细胞行为过程(包括迁移、黏附等)而消失,这种现象称为巨噬细胞消失反应(macrophage disappearance reaction, MDR)[2-4],且腹腔巨噬细胞的这种消失并不是因为细胞受刺激而死亡。研究报道,当腹腔注射脂多糖(lipopolysaccharide,LPS)、卡介苗疫苗、减毒化脓链球菌或酵母多糖等刺激物时,腹腔巨噬细胞仅数小时内就消失,并且恢复缓慢[5-6]。目前的研究仅发现了腹腔巨噬细胞消失的现象,但关于腹腔巨噬细胞消失的原因和机制是细胞生物学及免疫学领域亟需解决的重要难题,尚未报道有合适的实验方法来找寻消失的腹腔巨噬细胞,因此寻找一种有效体内示踪又不影响细胞生物学功能的标记方法尤为关键。
传统标记细胞方法
传统标记细胞的方法常见有细胞内荧光染色、核酸标记物及外源表达荧光蛋白等。
细胞内荧光染色
荧光染料CFSE(CFDA-SE),是一种可对活细胞进行荧光标记的新型染料,可以标记活体细胞。CFSE能够轻易穿透细胞膜,在活细胞内聚积并与胞内蛋白质共价结合,水解后的CFSE释放出荧光物质,这些共价结合的荧光物分子很少从细胞内脱落[7]。CFSE标记后的细胞用于体内观察;因此,CFSE常被用来做活细胞检测试验和用荧光显微镜观察细胞活动。然而,随着细胞的分裂,标记物也几乎等份地分配给两个子细胞,子细胞的荧光强度也随之下降。
Hoechst33342/DAPI等细胞核荧光染色剂,是一种可以穿透细胞膜的蓝色荧光染料,它在嵌入双链 DNA后释放强烈的蓝色荧光[8]。因此,也可以标记细胞,进行观测。其缺点是,核酸染色对细胞有毒性,且荧光容易在显微镜观察时发生猝灭。
核酸标记物
常用的有胸腺嘧啶同位素标记、5-溴脱氧尿嘧啶核苷(BrdU)标记等[9]。但这些核酸染料具有放射性污染、检测复杂、费时等缺点;另外标记细胞如果发生凋亡或死亡,其释放的BrdU则可掺入到处于细胞循环S期的任何细胞,从而难以区分移植细胞和宿主细胞。
外源表达荧光蛋白
构建表达荧光蛋白的慢病毒载体Lentiviralvector-GFP (绿色荧光蛋白)、Lentiviralvector-RFP (红色荧光蛋白)、Lentiviralvector-YFP (黄色荧光蛋白)[10]。通过细胞外源表达上述的荧光蛋白,使用荧光显微镜可以观察细胞的活动及变化。缺点是转染效率在不同的细胞中的差异性大,尤其是原代不增殖的细胞,最终会因为转染效率太低,而使荧光强度太低。
腹腔巨噬细胞,是腹腔内的主要免疫细胞,是原代细胞且不具有体外无限增殖的特性[11-12]。因而体外源表达荧光蛋白效率极低;另外腹腔巨噬细胞在体内迁移时,所进行标记方法(如BrdU等),会发生标记转移,以至于无法区分迁移还是原位的巨噬细胞。另一方面,任何标记方法都不允许改变巨噬细胞的活力(如Hoechst33342等,会产生细胞的毒性)。基于腹腔巨噬细胞的特点,上述传统标记方法不太适用于用腹腔巨噬细胞在体内的示踪。
DiO标记腹腔巨噬细胞
本研究中发现Di属于长链二烷基碳菁类染料,因其独特的结构使其具有极强亲脂性,可与脂溶性生物结构结合,在一定浓度下,可以对细胞膜进行完全染色[13]。Di染料被激发后具有很高的猝灭系数和激发态寿命,在细胞与组织定位示踪中起到了极大作用。常见的Di染料包括DiO、DiI和DiD等,在被激发后形成不同颜色的荧光。其中细胞膜绿色荧光活性染料 DiO(激发/发射波长为483/501 nm)是最常用的细胞膜荧光探针之一,由于其标记操作简便、细胞毒性较小、性质稳定,被广泛用于细胞或组织的示踪,嵌入生物质膜内并在膜内做侧向扩散运动从而标记整个细胞,对被标记细胞的存活、生长无影响(图1A)。
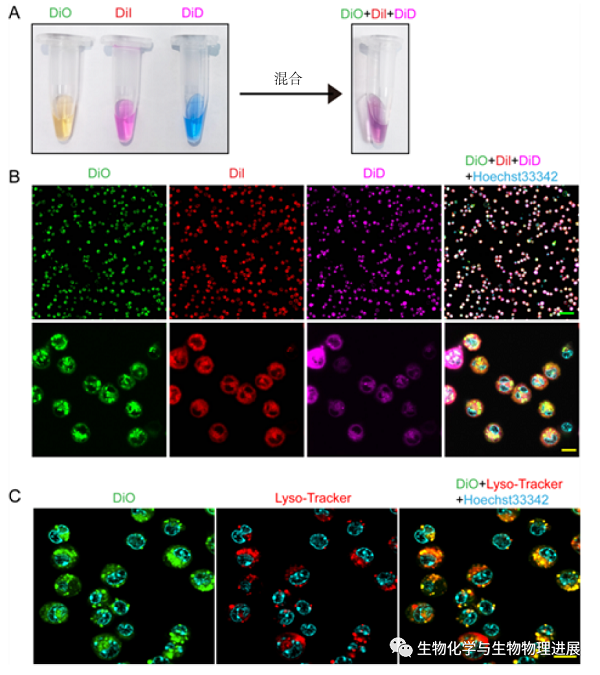
图1 亲脂性染料DiO,DiI和DiD可快速标记腹腔巨噬细胞
采用荧光显微镜观察DiO(绿色)、DiI(红色)及DiD(品红色)均能标记腹腔巨噬细胞(图1B)。但在相同的时间和浓度下,DiO除了染细胞膜外,可以发现其对细胞内溶酶体膜也能够染上荧光(图1C),具有较强的荧光强度。因此,本研究利用荧光活性染料DiO对腹腔巨噬细胞进行体外荧光标记,过继移植小鼠体内后通过LPS刺激,采用荧光显微镜、流式细胞仪和组织冰冻切片等检测手段,观察LPS诱导的腹腔MDR过程中,腹腔巨噬细胞分布情况的研究。
DiO标记腹腔巨噬细胞的示踪与定位
由于DiO标记的腹腔巨噬细胞的绿色荧光可以在小鼠体内保持96 h不猝灭且荧光强度不减,因而利用该实验优势,通过腹腔注射LPS构建MDR模型后,对消失的腹腔巨噬细胞进行示踪与定位。反应24 h后,取小鼠的外周血及不同组织(包括胸腺、脾脏、肝脏、肾脏、结肠、心脏、小肠、脑、肺脏以及脊髓)。将分离的组织经OCT包埋后,立即冰冻切片,通过荧光显微镜拍摄,结果发现在胸腺、脾脏及肝脏中存在DiO标记的腹腔巨噬细胞(图2)。然而,在肾脏、结肠、心脏、小肠、脑、肺脏、脊髓及外周血中并未发现DiO标记的腹腔巨噬细胞。这些结果表明,在MDR过程中,腹腔巨噬细胞可以从腹腔中迁移至多种脏器中(胸腺、脾脏及肝脏),这一现象目前未见报道,具体的机制及其功能有待于后续的深入研究。
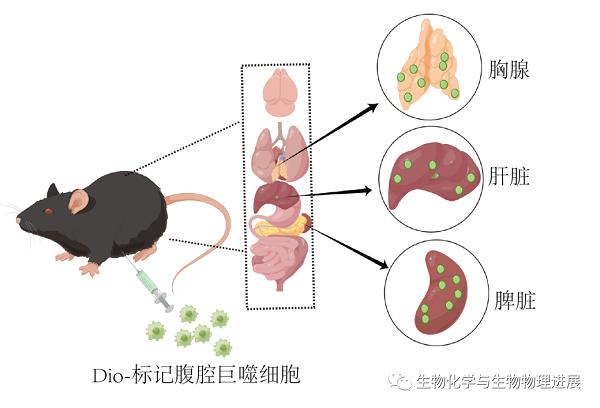
图2. DiO标记腹腔巨噬细胞的示踪与定位
展望
DiO是亲脂性荧光染料,易嵌入生物质膜内并在膜内作侧向扩散运动,从而使整个细胞膜被染色[13-15]。本研究在体外采用DiO标记腹腔巨噬细胞,发现标记过程对腹腔细胞无毒性,且对细胞的存活和生长无影响。DiO在进入细胞膜之前荧光非常弱,仅当进入到细胞膜后才可以被激发极强的绿色荧光,本研究证实,DiO能快速标记腹腔巨噬细胞,被标记的细胞形态良好及荧光稳定,在小鼠体内96 h荧光也未见减弱。因此,DiO标记可作为一种安全有效地观察腹腔巨噬细胞分布的技术手段。综上所述,该体内示踪技术应具备操作简单且费时少、荧光稳定且细胞毒性低和不受背景的干扰等特点。
华中科技大学协和深圳医院李陈广课题组通过DiO标记腹腔巨噬细胞的方法示踪LPS刺激后腹腔巨噬细胞的分布,操作简便,荧光稳定且细胞毒性较低,因此该研究手段将会为探索MDR过程中腹腔巨噬细胞的动态变化及相关生物学现象提供方便有效的实验手段。当然,本研究中仍存在一些不足,例如①我们只能靠显微镜观察到的荧光判断细胞是否存在,但是难以观察到细胞形态和存活状态。②在应答LPS诱导的MDR中的腹腔巨噬细胞,分别有过继移植的DiO标记的腹腔细胞及原腹腔的巨噬细胞。那么迁移到组织中就可能有部分是无荧光标记的腹腔巨噬细胞,从而造成迁移数量和荧光强度较低的影响,因此可预先使用体内巨噬细胞清除剂(clodronate liposomes)清除小鼠体内原腹腔中的巨噬细胞[16],再过继回输DiO标记的腹腔巨噬细胞来进一步完善该实验。另外,在MDR过程中,腹腔巨噬细胞如何迁移至上述组织中的机制以及对相应的组织会产生怎样的功能影响和存在何种调控方式等问题并未深入研究,也将作为后续进一步研究的重点方向,有效地追踪腹腔巨噬细胞在体内的归巢、迁移、分布、增殖等生物学行为,有利于对细胞药物治疗效果进行早期评估,为进一步研究腹腔巨噬细胞消失反应的原因和机制奠定了研究基础,本研究也将为后续免疫细胞示踪技术的发展与完善提供信息。(详情请点击阅读原文)
参考文献
[1] Murray P J, Wynn T A. Protective and pathogenic functions of macrophage subsets. Nat Rev Immunol, 2011, 11(11): 723-737
[2] Nelson D S, Boyden S V. The loss of macrophages from peritoneal exudates following the injection of antigens into guinea-pigs with delayed-type hypersensitivity. Immunology, 1963, 6(3): 264-275
[3] Ochiya T, Baba T, Mizushima A, et al. Induction of macrophage disappearance reaction by immunoadsorbed MIF. Cell Immunol, 1982, 71(2): 346-352
[4] Barth M W, Hendrzak J A, Melnicoff M J, et al. Review of the macrophage disappearance reaction. J Leukoc Biol, 1995, 57(3):361-367
[5] Guilliams M, Scott C L. Does niche competition determine the origin of tissue-resident macrophages?. Nat Rev Immunol, 2017, 17(7): 451-460
[6] Orsi M, Palmai-Pallag M, Yakoub Y, et al. Monocytic ontogeny of regenerated macrophages characterizes the mesotheliomagenic responses to carbon nanotubes. Front Immunol, 2021, 12: 666107
[7] Quah B J, Warren H S, Parish C R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat Protoc. 2007, 2(9):2049-2056
[8] Schmid I, Uittenbogaart C, Jamieson B D. Live-cell assay for detection of apoptosis by dual-laser flow cytometry using Hoechst 33342 and 7-amino-actinomycin D. Nat Protoc, 2007, 2(1):187-190
[9] Schmidt A, Sucke J, Fuchs-Moll G, et al. Macrophages in experimental rat lung isografts and allografts: infiltration and proliferation in situ. J Leukoc Biol, 2007, 81(1):186-194
[10] Leiker M, Suzuki G, Iyer V S, et al. Assessment of a nuclear affinity labeling method for tracking implanted mesenchymal stem cells. Cell Transplant, 2008, 17: 911-922
[11] Orsi M, Palmai-Pallag M, Yakoub Y, et al. Monocytic ontogeny of regenerated macrophages characterizes the mesotheliomagenic responses to carbon nanotubes. Front Immunol, 2021, 12: 666107
[12] Zhang N, Czepielewski R S, Jarjour N N, et al. Expression of factor V by resident macrophages boosts host defense in the peritoneal cavity. J Exp Med, 2019, 216(6): 1291-1300
[13] Han Y, Zhang Z, Liu W, et al. A labeling strategy for living specimens in long-term/super-resolution fluorescence imaging. Front Chem, 2020, 8: 601436
[14] Wang G, Wang Z, Sun N, et al. Reactive oxygen speciesresponsive silk sericin microcapsules used for antioxidative stress damage. Microsc Res Tech, 2021, 84(4): 618-626
[15] Chen C C, Chen J, Wang W L, et al. Inhibition of the P53/P21 pathway attenuates the effects of senescent nucleus pulposus cellderived exosomes on the senescence of nucleus pulposus cells. Orthop Surg, 2021, 13(2): 583-591
[16] Li R, Yang L, Jiang N, et al. Activated macrophages are crucial during acute PM2.5 exposure-induced angiogenesis in lung cancer. Oncol Lett, 2020, 19(1): 725-734
作者简介
麦凤怡:方科技大学医学院博士研究生,主要研究方向为免疫细胞与肿瘤代谢的相关机制。
(作者:麦凤怡)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: