肺纤维化(pulmonary fibrosis,PF)是一种严重的慢性肺间质损伤性的炎症疾病,主要症状表现为干咳、咳痰、胸闷、乏力、呼吸困难等。人体肺纤维化可以导致肺部的正常组织结构改变,肺功能下降,导致机体缺氧,严重的可能会导致死亡。该疾病严重威胁人类健康,其发病机制尚未完全阐明,目前缺少有效的治疗手段,如何延缓甚至逆转其进展一直是呼吸系统疾病领域的研究热点和难点问题[1]。

哮喘、感染性肺炎、慢性阻塞性肺病以及肺纤维化等慢性肺病患者常常伴有肠道症状,且肠道损伤的程度与肺部病变的严重程度高度一致,存在肠肺之间的相互调节过程(crosstalk)[2]。人体微生物菌群大部分存在于胃肠道,此类微生物及代谢物能与宿主相互作用进而影响人体健康。因此,肠道菌群及其代谢物可能通过血液和淋巴系统在肠道与肺部组织之间相互联系并引发双向作用,而此调控网络或信息交流系统称为肠肺轴(gut-lung axis)[3]。
肠菌失调与肺纤维化
健康人体的肠道中定植有大量微生物群落,细菌数量总数大约有1014个,构成1000多个生物学种群。肠道菌群失调不仅调节人体胃肠道的免疫反应,还能调节肺、脑、肝等远端器官的病理状况和免疫水平。肠道菌群含菌密度达到1011~1012个/克,肺组织中细菌的总数相对较少,含菌密度只有103~105个/克的水平。肠道和肺部微生物群结构水平类似但略有差异,当肺部发生炎症反应时,肺部定植的菌群也可引起血液和肠道微生物群的变化调节胃肠道功能[4]。肠道菌群生态失调受多种内外因素影响,比如药物、饮食、抽烟、生活方式等。动物研究表明,小鼠幼年的抗生素暴露引起的肠道菌群失调能够促进成年小鼠的皮肤和肺部纤维化症状的形成[5]。利用小鼠模型对特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)和矽尘诱导肺纤维化(silicosis)研究发现,412个属的肠道菌与26种代谢物发生显著变化,例如螺杆菌属等细菌丰度明显下调,而杜氏杆菌属细菌丰度显著升高,并且杜氏杆菌丰度与血清中甜菜碱水平呈明显正相关。因此,该研究首次验证了使用肠道菌群和代谢物作为纤维化进程生物标志物的可能性与可靠性[6]。囊性肺纤维化(cystic pulmonary fibrosis,CPF)患者肠道菌群中葡萄球菌属、链球菌属和韦荣氏球菌属丰度明显增高,但拟杆菌、青春双歧杆菌、普拉梭菌的丰度显著下降,且菌群丰度与患者肺部功能、病情恶化和疾病严重程度密切相关[7]。矽肺纤维化人群肠道中,变形菌门和疣微菌门的菌群丰度明显增高,但厚壁菌门和放线菌门的菌群丰度明显下降,该结果也为矽肺纤维化人群的菌群干预提供了前期理论基础[8]。
肠肺轴调控机理
肠肺轴在肺部疾病发病机制中的调节作用是一个备受关注的新兴领域。肠肺之间调节功能体现在微生物菌群、免疫功能和代谢物调节三个层面的水平,定植于消化系统和呼吸系统黏膜组织的菌群是发挥调控作用的生物学基础。首先,肠道细菌构成组分可通过血流循环运输的方式进行肠肺之间的"信息交流",肠道各菌群的丰度和定植位置的变化能够导致肺部免疫系统紊乱和呼吸道疾病的发生。其次,肠道菌群在呼吸系统黏膜免疫中能够发挥重要作用,肠道菌群能够明显影响机体内免疫细胞和分子的释放和循环。再次,人体能够通过感受和识别微生物代谢物的方式来对肺部病理反应产生防御作用。
干预策略
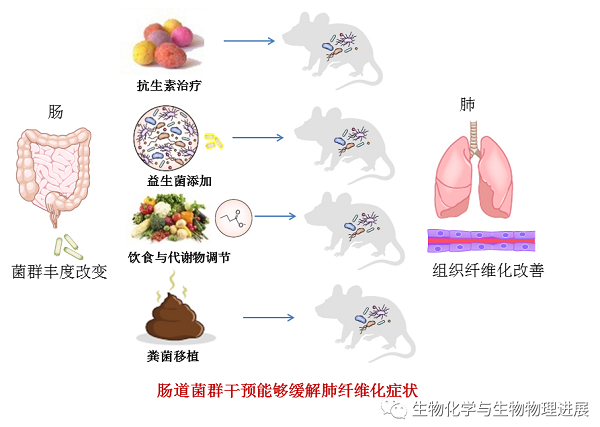
我们了解肠道菌群在肺纤维化等肺部疾病中的调节作用和规律最终是为了利用肠菌外源干预相关疾病。近年来研究较多的菌群干预模式主要有抗生素治疗、益生菌添加、饮食调节、粪菌移植等方法。例如,链霉素治疗可以明显降低CPF模型小鼠中肠道乳酸杆菌的丰度,并通过抑制该菌生长促进Th17等T细胞增殖,从而抑制机体肺部气道的高反应性[9]。益生菌是能够改变宿主某一部位菌群组成的一类对宿主有益的活性微生物,常用菌种为双歧杆菌和乳杆菌。通过添加益生菌制剂调控肺部疾病已经成为肠道菌群功能研究的热点领域,口服益生菌能够通过多种信号途径来调控肺部免疫反应。例如,在CPF成年和儿童患者中服用罗伊氏乳杆菌可造成厚壁菌比例升高,而变形菌的比例下降,推测可能通过下调肠中粪钙卫蛋白的水平而降低患者病情恶化的风险,但需更多的临床试验来评估益生菌的有效性和安全性[10-11]。饮食习惯也是是重塑肠道菌群构成的主要的外源环境因素,饮食中母乳、牛奶、脂肪和膳食纤维等营养物质能够明显影响肠道菌群的丰富度[12]。例如,维生素D在肠道黏膜系统炎症中具有重要的介导作用,也可作为一种辅助治疗CPF和IPF纤维化疾病的肠菌调节剂来进行疾病干预[13-14]。近年来粪菌移植(fecal microbiota transplantation, FMT)方法也逐渐被考虑应用到肺纤维化的辅助治疗中。在肺纤维化无菌小鼠FMT研究中,移植ABSL-1安全级别小鼠粪便菌群的无菌小鼠肠道乳杆菌比例大幅上升,能通过抑制肺成纤维细胞产生胶原I的水平来减轻肺部纤维化程度,而肠菌多样性较低的ABSL-2级小鼠FMT干预的效果较差[15]。但是FMT方法对肺纤维化疾病的干预研究现今仍处于初期探索阶段,亟待临床数据的充实。
展望
近年关于肠肺轴调控的研究成果逐渐增多,为肺纤维化疾病的治疗研究提供了崭新的思路和视角。内外环境因素引发的肠道菌群及代谢物的多样性和特异性改变与肺组织中的免疫反应和炎症通路密切相关,但仍欠缺细胞和分子机制的具体阐述,标准的菌群干预研究也亟待系统探讨,肠道中细菌之外的微生物群落的功能还需深入挖掘。可以设想在不久的将来,利用肠肺轴理论设计的各型肠菌干预制剂,必定给广大肺纤维化疾病患者带来自由与健康呼吸的春天。(详情请点击阅读原文)
参考文献
[1] Thannickal V J, Toews G B, White E S, et al. Mechanisms of pulmonary fibrosis. Annu Rev Med, 2004, 55:395-417
[2] Ojha U C, Singh D P, Choudhari O K, et al. Correlation of severity of functional gastrointestinal disease symptoms with that of asthma and chronic obstructive pulmonary disease: a multicenter study. Int J Appl Basic Med Res, 2018, 8(2): 83-88
[3] Wu Y, Li Y, Luo Y, et al. Gut microbiome and metabolites: the potential key roles in pulmonary fibrosis. Front Microbiol, 2022, 13: 943791
[4] Zhang D, Li S, Wang N, et al. The cross-talk between gut microbiota and lungs in common lung diseases. Front Microbiol, 2020, 11: 301
[5] Ho K J, Varga J. Early-life gut dysbiosis: a driver of later-life fibrosis?. J Invest Dermatol, 2017, 137(11): 2253-2255
[6] Gong G C, Song S R, Su J. Pulmonary fibrosis alters gut microbiota and associated metabolites in mice: an integrated 16S and metabolomics analysis. Life Sci, 2021, 264: 118616
[7] Enaud R, Hooks K B, Barre A, et al. Intestinal inflammation in children with cystic fibrosis is associated with crohn's-like microbiota disturbances. J Clin Med, 2019, 8(5): 645
[8] Zhou Y, Chen L, Sun G, et al. Alterations in the gut microbiota of patients with silica-induced pulmonary fibrosis. J Occup Med Toxicol, 2019, 14: 5
[9] Bazett M, Bergeron M E, Haston C K. Streptomycin treatment alters the intestinal microbiome, pulmonary T cell profile and airway hyperresponsiveness in a cystic fibrosis mouse model. Sci Rep, 2016, 6: 19189
[10] Coffey M J, Garg M, Homaira N, et al. Probiotics for people with cystic fibrosis. Cochrane Database Syst Rev, 2020, 1(1): CD012949
[11] Del Campo R, Garriga M, Pérez-Aragón A, et al. Improvement of digestive health and reduction in proteobacterial populations in the gut microbiota of cystic fibrosis patients using a Lactobacillus reuteri probiotic preparation: a double blind prospective study. J Cyst Fibros, 2014, 13(6): 716-722
[12] Wypych T P, Wickramasinghe L C, Marsland B J. The influence of the microbiome on respiratory health. Nat Immunol, 2019, 20(10): 1279-1290
[13] Kanhere M, Chassaing B, Gewirtz A T, et al. Role of vitamin D on gut microbiota in cystic fibrosis. J Steroid Biochem Mol Biol, 2018, 175: 82-87
[14] Mercader-Barceló J, Truyols-Vives J, Río C, et al. Insights into the role of bioactive food ingredients and the microbiome in idiopathic pulmonary fibrosis. Int J Mol Sci, 2020, 21(17): 6051
[15] Chioma O S, Mallott E K, Chapman A, et al. Gut microbiota modulates lung fibrosis severity following acute lung injury in mice. Commun Biol, 2022, 5(1): 1401
作者简介
师晓栋:国家卫生健康委职业安全卫生研究中心副研究员,课题负责人,主要研究方向为矽尘诱导肺纤维化的分子毒理学和免疫调控机理,非编码RNA在尘肺疾病中的调节作用研究。
(作者:师晓栋)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: