疱疹病毒是一类具有囊膜的双链DNA病毒,能够感染包括人类在内的几乎所有脊椎动物及部分无脊椎动物。疱疹病毒主要感染皮肤、黏膜和神经等组织,引发感染部位产生多种疾病,严重威胁人类和其他动物的健康。目前已经发现9种能够感染人类的疱疹病毒,造成单纯疱疹与生殖器疱疹(HSV-1与HSV-2感染)、水痘与带状疱疹(VZV感染)、传染性单核白血球增多症与鼻咽癌(EBV感染)、卡波西氏肉瘤(KSHV感染)等疾病。疱疹病毒的结构由内而外依次是基因组DNA、衣壳、间质蛋白层和囊膜(图1)。
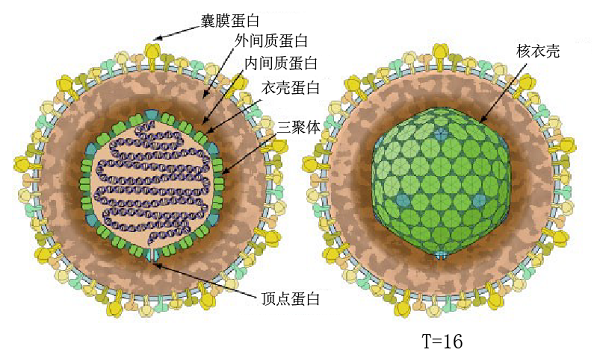
图1 疱疹病毒的结构
疱疹病毒的生命周期
根据特征性基因表达情况的不同,疱疹病毒感染宿主呈现两种感染历程,分别是潜伏期(latency)和裂解期(lytic reactivation)[1]。在潜伏期,病毒基因组在细胞内环化,并以附加体(episome)的形式结合在染色体上。这个时期不会产生病毒颗粒,仅仅表达一小部分基因。在外界刺激下,疱疹病毒可由潜伏期进入裂解期[2]。如图2所示,在裂解期,从头感染的病毒首先通过囊膜上的糖蛋白与宿主细胞膜表面上的受体结合,随后通过病毒囊膜与细胞膜的融合进入细胞。病毒颗粒进入细胞后,部分间质蛋白从核衣壳上解离下来,核衣壳通过微管运输到细胞核附近,通过核孔将病毒基因组DNA释放到细胞核中。在细胞核中进行基因组DNA复制及病毒蛋白的表达,并完成病毒基因组的包装,组装成新的核衣壳。组装完成的核衣壳需要在核释放复合体(NEC)的辅助下跨越两层细胞核膜,从而进入到细胞质中。接着病毒颗粒在细胞质中获得间质蛋白和囊膜进一步成熟。最后,成熟的病毒颗粒经由胞吐作用释放到细胞外,进而感染其他的细胞[3]。

图2 疱疹病毒的生命周期
间质化
间质(tegument)是疱疹病毒特有的蛋白质层,是连接病毒衣壳和囊膜的桥梁。由于间质缺乏良好的对称性,无法通过冷冻电子显微镜对病毒颗粒进行结构解析,因此目前没有间质清楚的结构信息。根据间质蛋白在病毒颗粒上的位置,间质蛋白又被分为外间质蛋白和内间质蛋白,内间质蛋白连接衣壳和外间质蛋白,外间质蛋白则连接内间质蛋白和病毒囊膜,进而形成紧密的病毒颗粒(图1)。间质蛋白种类众多,在HSV-1、HCMV以及EBV中已经分别发现至少26、38和17种间质蛋白[4]。那么,这些间质蛋白是如何高效组装到病毒衣壳上的,一直是科研人员研究的热点问题之一。
对疱疹病毒MHV-68间质化研究发现,病毒利用液液相分离在感染细胞内建立病毒组装区间(或者称为病毒工厂),这种无膜类细胞器的建立依赖病毒间质蛋白ORF52。如图3所示,作为组装区间形成的核心,ORF52通过间质蛋白之间复杂的相互作用网络,招募其他间质蛋白如ORF45、ORF33、ORF38至ORF52形成的液滴中,进而形成包含多种病毒间质蛋白的区间[5]。当细胞质中的衣壳通过某种方式与组装区间识别后,这些间质蛋白能够依次迅速结合到衣壳上。与衣壳在偌大的细胞质空间中逐一结合间质蛋白相比,这种方式极大地提高了病毒的间质化效率。
另外,在疱疹病毒间质化过程中,存在大量间质蛋白-间质蛋白间的相互作用,这些相互作用在病毒组装和释放过程中发挥十分重要的作用。例如,MHV-68编码的间质蛋白ORF33和ORF45具有相互作用,破坏二者之间的相互作用阻碍了病毒在细胞质中的成熟[6]。数十种间质蛋白通过十分复杂的相互作用网络组装到核衣壳上,最终产生成熟的病毒颗粒。
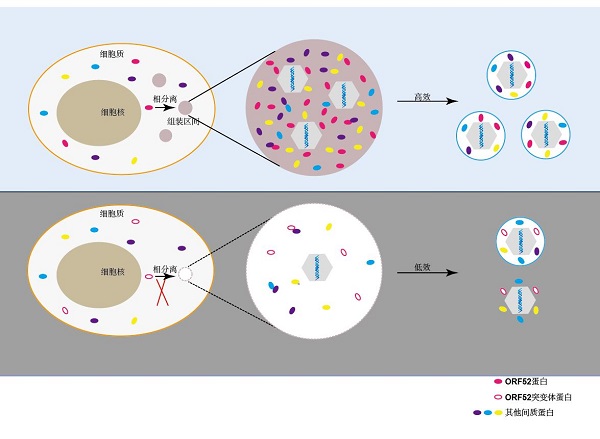
图3 核衣壳在病毒组装区间进行间质化和二次囊膜化的示意图
间质化的核衣壳通过出芽方式进入特殊囊泡获得病毒糖蛋白,形成成熟病毒颗粒。疱疹病毒二次囊膜化需要的囊泡主要来源于反式高尔基体以及早期胞内体。这些囊泡上包含大多数病毒糖蛋白以及少数膜相关的间质蛋白,通过与衣壳上结合的间质蛋白相互作用,促进衣壳与囊泡的融合,从而帮助病毒完成二次囊膜化过程(图2、3)。在病毒二次囊膜化后期,新形成的病毒颗粒需要与囊泡分离,在这个过程中,细胞蛋白内体分选复合体(ESCRT)被认为起到了关键作用。研究表明,几乎所有疱疹病毒都需要ESCRT帮助病毒行使膜剪切的功能。
展望
疱疹病毒是一类非常古老的DNA病毒,在与宿主漫长的博弈过程中,病毒不断优化自身的复制策略,以提高病毒的生存能力。液液相分离作为细胞内无膜细胞器形成的主要驱动力,亦被疱疹病毒利用作为其高效复制的重要手段,进一步充分说明病毒的聪明和狡猾。道高一尺,魔高一丈。随着对病毒复制机理更加深入的探索,越来越多的潜在治疗靶点也逐渐被发现。我们相信,未来科学研究的成果将会彻底消除疱疹病毒对人类健康的威胁。
参考文献:
1. Cai Q, Verma S C, Lu J, et al. Molecular biology of Kaposi's sarcoma-associated herpesvirus and related oncogenesis. Adv Virus Res, 2010, 78: 87-142
2. Ballestas M E, Chatis P A, Kaye K M. Efficient persistence of extrachromosomal KSHV DNA mediated by latency-associated nuclear antigen. Science, 1999, 284(5414): 641-644
3. Draganova E B, Valentin J, Heldwein E E. The Ins and Outs of herpesviral capsids: divergent structures and assembly mechanisms across the three subfamilies. Viruses, 2021, 13(10): 1913
4. Guo H, Shen S, Wang L, et al. Role of tegument proteins in herpesvirus assembly and egress. Protein Cell, 2010, 1(11): 987-998
5. Zhou S, Fu Z, Zhang Z, et al. Liquid-liquid phase separation mediates the formation of herpesvirus assembly compartments. J Cell Biol, 2023, 222(1):e202201088
6. Jia X, Sun L, Shen S, et al. The interaction between tegument proteins ORF33 and ORF45 plays an essential role in cytoplasmic virion maturation of a gammaherpesvirus. J Virol, 2022, 96(22): e0107322
作者简介:
周胜

中国科学院生物物理研究所,博士后,主要开展疱疹病毒组装释放的研究工作。
孙龙

中国科学院生物物理研究所,博士(已毕业)。
邓红雨
中国科学院生物物理研究所研究员,主要研究方向为:病毒复制的分子机理及病毒与宿主的相互作用。
科学寄语
君子以自强不息!
 附件下载:
附件下载: