皮肤是人体的最大器官,承担着多种生理学作用。吸收是皮肤非常重要的能力,生理状态下皮肤主要通过3个途径吸收外界物质和成分,即角质层、毛囊皮脂腺和汗管口。经皮给药是指药物通过皮肤给药,在1981年被批准用于临床[1],它是继口服给药和注射给药之后的第三大给药系统。经皮给药的优点是操作方便,同时减少系统用药带来的副作用。然而,传统经皮给药即药物外涂的缺点是效率低下,生物大分子经皮运输困难,需要找到适当的方法来提高经皮给药效率,由此,微针经皮给药的概念就产生了。
微针经皮给药技术的由来
通过化学或物理方法可以提高成分或药物的渗透,比如增加皮肤水合程度、添加化学促渗剂、使用前体药物、包埋目标化合物,或者改变角质层屏障[2]。在如今日常生活和临床中,面膜的使用、涂抹药物后配合封包或湿包疗法,以及微针的应用等都是常用的促渗透手段。传统微针由多个微米级针以阵列方式附着在基座上而成,通常针体高度为10~2000 μm,宽度为10~50 μm。目前报道已有新型的纳米级别微针出现[3],通常尖端直径小于500 nm。微针可以在不伤害或最小伤害皮肤真皮层的条件下,快速打开皮肤通道,从而将药物输送进入皮肤。微针概念出现的时间距今并不久远,Gerstel和Place于1976年首次报道了将微针作为药物输送系统使用[4],为微针系统在透皮给药系统中的应用奠定了基础。从20世纪70年代出现至今,微针逐渐在药物输送和其他应用领域都取得了诸多进展[5]。
微针经皮给药技术的应用现状
根据微针给药的方式,可以将微针分为5种类型[6]:(1)实心/固体微针:由金属或不能降解的材料制成,在皮肤上打开即时微通道,允许药物或功效性成分更好地渗透。目前医美领域常用的纳米微针(图1)及滚针(图2)就属于固体微针。(2)涂层/包被实心微针,在微针针体和针尖上涂有活性成分,刺入皮肤后涂层成分在皮肤内快速溶解。(3)中空微针,利用空心微针刺破皮肤形成的微针孔/针腔将液体药物注入皮肤。目前医美领域的美塑疗法中常用此微针连接负压后经皮给药,俗称"水光针"(图3)。(4)溶解型微针,由生物可降解和生物兼容的材料制成,易于在体液中降解和溶解,从而释放装载的药物成分。日本著名美妆品牌Quanis克奥尼斯的微针眼贴(图4),就是将玻尿酸制成200 μm的微针形态,通过按压刺入皮肤,起到皮肤深层补水的作用。(5)水凝胶微针,由可膨胀的水凝胶聚合性材料制成,微针刺破皮肤后,快速吸收组织液膨胀,药物再通过膨胀的水凝胶微针形成的微孔道输送出来。

近年来,微针经皮给药技术应用广泛,可用于传输药物、化妆品、蛋白质或多肽、寡核苷酸和疫苗等[7]。在皮肤医美领域,微针也被广泛应用于皮肤年轻化;损容性皮肤病如痤疮、黄褐斑、脱发等疾病的治疗;以及疾病或其他原因引起的瘢痕、萎缩纹等的治疗中。
在微针技术蓬勃发展的同时,该技术也面对着各种挑战,需要继续进行大量的研究和试验才能获得临床批准。和微针经皮给药技术评价相关的主要因素有微针穿刺性能的参数和指标;生物组织相容性、生物降解性和稳定性;微针装载能力和用量的准确性;制造成本以及皮肤刺激性和其他不良反应等[8]。
真实皮肤和皮肤模型在评价微针穿刺性能中的作用
在微针透皮给药技术相关研究和试验中,真实皮肤和皮肤模型各有其局限性和优点,为微针透皮给药技术的开发提供了多种参考。使用人体或动物真实皮肤进行试验可以帮助直观准确地评价试验结果,但涉及伦理道德问题,使用的药物或成分可能具有潜在有害影响,且试验成本高。相比真实皮肤,皮肤模型易于标准化,试验效率和可重复性高,更符合伦理要求,但部分皮肤模型同样存在高成本问题,且缺少组织炎症反应和自我愈合修复机制、缺少血管网、不能完全模拟真实皮肤脂质构成和皮肤的全部功能[9]。但从微针商业化角度来看,皮肤模型不失为建立评价标准的可取路径。
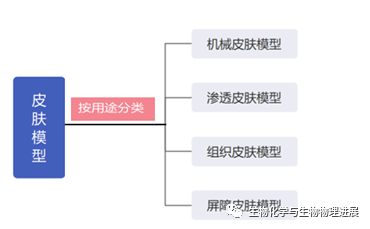
常见皮肤模型
机械皮肤模型应用于评价微针等经皮递送系统的机械性能。有研究用Sylgard 184 PDMS做角质层,TC-5005 A/B/C PDMS做表皮,该模型便于观察刺入孔洞大小,可推断刺入深度[10];有研究用八层石蜡膜做模型,也便于观察微针刺入孔洞大小,但不能准确反映刺入深度[11];另有研究用硅胶膜代替角质层,聚醚发泡棉/琼脂代替表皮以下组织,该模型中发泡棉/凝胶起到对硅胶膜的支撑和抗震缓冲作用,但不能准确模拟皮肤性质[12-13]。
渗透皮肤模型主要适用于评价经皮递送的小分子药物的渗透性。有研究用电纺丝喷涂PVA AH 26和N,N-二甲基甲酰胺混合溶液制得,模拟真实组织的渗透性能,可作为快速便捷的体外评价材料,但仅对真皮层进行了模拟,无法作为微针刺入完整皮肤的体外评价模型[14]。有研究用石蜡膜扩散装置做模型,操作简便,可评估不同药物的渗透情况;不适用于水凝胶微针的渗透性评价[15]。
组织皮肤模型是利用先进的组织工程技术,将人源皮肤细胞培养于特殊的插入式培养皿上建构而成,其在基因表达、组织结构、代谢活力等方面高度模拟人体皮肤[16]。有研究将角蛋白膜黏附在聚二甲基硅氧烷弹性体(PDMS)上,软化的角蛋白膜硬度与人角质层相近,针刺皮肤模型后出现动物皮肤特有的黏滑现象[17]。
屏障皮肤模型主要模拟皮肤的屏障功能,为皮炎、烧伤患者的创面提供闭塞治疗。屏障皮肤模型一般不用于微针穿刺性能评价。
展望
本文介绍了微针经皮给药技术及皮肤模型在微针穿刺性能评价中的应用情况,整体上皮肤模型比真实皮肤在实验中更具有可行性和推广价值。皮肤模型具有多样性,根据其用途,皮肤模型分为机械皮肤模型、渗透皮肤模型、组织皮肤模型和屏障皮肤模型。它们在材料、结构、外观上各有不同,研究者可根据自己的需要选择相应的皮肤模型。在微针经皮给药的评价试验中,皮肤模型需要具备较难刺破的屏障、与真实皮肤类似的硬度、弹性和韧性,具有与人或动物皮肤相近的渗透性,以评价针刺性能及药物扩散渗透情况。然而,现有的皮肤模型与真实皮肤的物理特性仍存在一定差距,这是在制备相应皮肤模型时需要首先解决的问题。(详情请点击阅读原文)
参考文献
[1] Prausnitz M R. Microneedles for transdermal drug delivery. Adv Drug Deliv Rev, 2004, 56(5): 581-587
[2] Prausnitz M R, Langer R. Transdermal drug delivery. Nat Biotechnol, 2008, 26(11): 1261-1268
[3] Hu L, Zhao K, Song W M. Effect of mesotherapy with nanochip in the treatment of facial rejuvenation. J Cosmet Laser Ther, 2020, 22(2):84-89
[4] Gerstel M S, Place V A. Drug Delivery Device:USA, US-3964482-A, 1976-06-22
[5] Tasca F, Tortolini C, Bollella P, et al. Microneedles-based electrochemical devices for transdermal biosensing: a review. Curr Opin Electrochem, 2019, 16: 42-49
[6] Bilal M, Mehmood S, Raza A, et al. Microneedles in smart drug delivery. Adv Wound Care (New Rochelle), 2021, 10(4): 204-219
[7] Waghule T, Singhvi G, Dubey S K, et al. Microneedles: a smart approach and increasing potential for transdermal drug delivery system. Biomed Pharmacother, 2019, 109:1249-1258
[8] Avcil M, Celik A. Microneedles in drug delivery: progress and challenges. Micromachines (Basel), 2021, 12(11):1321
[9] Supe S, Takudage P. Methods for evaluating penetration of drug into the skin: a review. Skin Res Technol, 2021, 27(3):299-308
[10] Ranamukhaarachchi S A, Schneider T, Lehnert S, et al. Development and validation of an artificial mechanical skin model for the study of interactions between skin and microneedles. Macromol Mater Eng, 2016, 301(3): 306-314
[11] Lhernould M S, Deleers M, Delchambre A. Hollow polymer microneedles array resistance and insertion tests. Int J Pharm, 2015, 480(1-2): 152-157
[12] 呼东亮. 微针及其阵列刺入硅胶实验研究[D]. 大连: 大连理工大学, 2016
[13] 侯俊杰. 微针阵列刺入皮肤的理论与实验研究[D]. 大连: 大连理工大学, 2013
[14] 沈炎冰, 朱嗣文, 吴飞, 等. 用于微针贴剂快速体外评价的电纺丝纤维真皮层模型. 中国医药工业杂志, 2017, 48(10): 1474-1478
[15] Larraneta E, Stewart S, Fallows S J, et al. A facile system to evaluate in vitro drug release from dissolving microneedle arrays. Int J Pharm, 2016, 497(1-2): 62-69
[16] Kwak B S, ChoiW, Jeon J W, et al.In vitro 3D skin model using gelatin methacrylate hydrogel. J Ind EngChem, 2018, 66: 254-261
[17] Nishino R, Aoyagi S, Suzuki M, et al. Development of artificial skin using keratin film for evaluation of puncture performance of microneedle. J Robot Mechatron, 2020, 32(2): 351-361
作者简介
杨慧:上海交通大学医学博士,杭州颜术新芽诊所皮肤科主任。
杜雪:南京大学硕士研究生,现为杭州颜术皮肤医美医生。
(作者:杨慧、杜雪、宋伟民、马凤森)
(本文来源于公众号:生物化学与生物物理进展)
 附件下载:
附件下载: