多囊泡体(multivesicular bodies, MVBs)是单层膜包被的、直径在200~1000 nm之间,腔内包含多个微小囊泡的晚期内吞体。MVB最初是在20世纪50年代的神经系统被观测到,其辨别的"金标准"是电镜下一个大的囊泡包含多个腔内囊泡(intralumenal vesicles, ILVs)的特殊形态。作为细胞内的一种重要细胞器,MVB主要负责递送内吞途径上的货物分子到溶酶体中降解和循环利用,调控营养摄取、免疫和信号转导等生物学过程。此外,MVB也可与细胞质膜融合释放ILV,以外泌体的形式发挥细胞间通讯作用。病理条件下,肿瘤组织分泌的外泌体可通过改变肿瘤微环境、促进血管发生和修饰机体免疫系统促进肿瘤的发生发展[1]。因此,作为溶酶体降解通路的关键递送路径和外泌体生成的起源,MVB生成的机制研究具有重要的生理和临床意义。
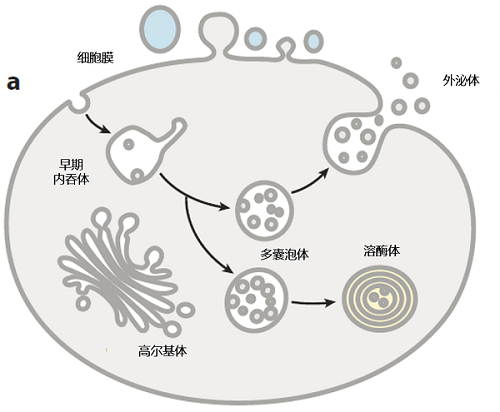
图1:MVB及其在细胞中的主要命运[2]
MVB广泛存在于从酵母到高等哺乳动物的真核细胞内,其形态、分布、组成内容物及在细胞内的去向具有高度异质性,并和特定生理功能相关联,暗示细胞内存在着多样化的机制介导不同MVB类群的产生。MVB由早期内吞体不断成熟而来,其腔内囊泡的形成伴随着内吞体膜上货物分子的分选富集、膜内陷及出芽等膜重塑过程。近年来的研究鉴定了多个调控MVB生成的因子,根据其效应蛋白和作用机制划分,这些因子调节MVB形成的机制可分为3大类:ESCRT复合物依赖的机制、特定脂质分子驱动的机制和四次跨膜家族蛋白驱动的机制[3]。
ESCRT依赖的MVB生成通路
内吞体运输必需分选复合物(endosomal sorting complexes required for transport, ESCRT)在调控MVB的形成中发挥关键作用。经典的ESCRT通路包含5个不同的复合物ESCRT-0、 -I、-II、-III和相关的AAA-ATP酶复合物VPS4。在形成降解性MVB中,ESCRT复合物的功能研究得较为清楚。在这一过程中,ESCRT复合物通过在内吞体膜上时序性招募组装,最终介导泛素化的膜受体蛋白被分选至ILV中,进而送至溶酶体被降解。具体来说,首先内吞体膜上的PI3P和泛素化的受体蛋白招募ESCRT-0到内吞体膜上,ESCRT-0通过与网格蛋白的相互作用,在膜上团聚形成微结构域,富集货物蛋白于特定位置;然后,ESCRT-0接着招募ESCRT-I,将泛素化的货物蛋白呈递给ESCRT-I, ESCRT-I继续招募ESCRT-II,组装成超大复合物,诱导内吞体膜发生形变, 把分选的货物蛋白聚集在出芽位置;ESCRT-II继续招募ESCRT-III, 促进ESCRT-III组分在内陷囊泡的"颈部"区域多聚化形成丝状螺旋,进一步收紧囊泡"颈部"区域,同时诱导货物蛋白的去泛素化;最后,VPS4复合物诱导ESCRT-III复合物去组装,促进内陷囊泡的"镒缩",从膜上脱离下来,同时回收利用ESCRT-III组分[4- 5]。
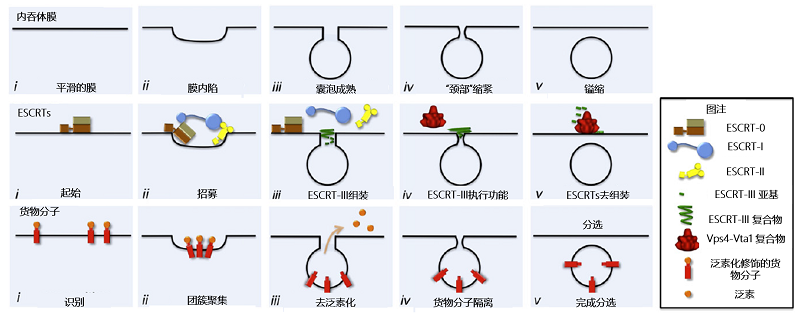
图2:经典的ESCRT通路调控MVB生成模式图[5]
除了上述需要所有ESCRT组分参与的经典ESCRT通路,近年来的研究也鉴定了多条只需要部分ESCRT组分参与的MVB生成调控机制。例如,(1)酵母里的Bro1蛋白可以作为泛素受体,与ESCRT-0组分并行地调控ILV形成;(2)Bro1蛋白可替代ESCRT-I和ESCRT-II的功能,作为ESCRT-0和ESCRT-III的直接桥梁蛋白,介导ESCRT-III组分的招募和下游的ILV形成。在哺乳动物细胞中,研究者们发现ALIX蛋白以不依赖ESCRT-0、而依赖ESCRT-III的机制参与包裹Syndecan-syntenin货物的MVB形成。此外,也有研究表明ALIX蛋白可通过与晚期内吞体上的溶血磷脂酸的结合进而直接招募ESCRT-III调控MVB形成。最后,另一个包含Bro1结构域的HD-PTP蛋白可作为支架蛋白组成性地招募ESCRT-0、-I和-III组分,介导ILV形成[4]。值得一提的是,上述非经典的ESCRT通路似乎都需要ESCRT-III组分的参与来调控MVB形成。
特定脂质分子驱动的MVB生成机制
除了ESCRT组分及其相关蛋白质,MVB也可以不依赖ESCRT途径而由特定脂质分子介导形成。目前发现参与调控MVB形成的脂类主要包括神经酰胺、磷脂酸、鞘氨醇-1-磷酸等。有别于经典的ESCRT通路研究,这些脂类具体的作用机制仍不是很清楚。根据鉴定到的脂类调控因子的性质和相关研究结果,研究者们提出的假说主要包括以下3种:(1)神经酰胺可促进内吞体膜上富含鞘磷脂的"脂筏"微结构域的形成和进一步扩张,从而诱导内吞体膜的出芽生长;(2)神经酰胺和磷脂酸等脂类结构上类似椎形,即具有较小的亲水头部和较大的疏水尾巴,因此当其嵌入到内吞体膜上时能诱发自发的负性曲度(即膜向内凹陷),从而促进ILV的形成。(3)鞘氨醇-1-磷酸(sphingosine-1-phosphate, S1P)可以作为脂类信号,激活下游S1P受体,激活的S1P受体通过激活调控微丝聚合的小G蛋白CDC42和Rac1,促进内吞体膜上微丝的聚合促进货物分选至ILV,从而调控MVB形成[6-9]。
四次跨膜家族蛋白驱动的MVB生成机制
此外,近年来的研究也鉴定了多个四次跨膜家族蛋白成员(CD63、CD9、CD82、CD81等)参与调控分泌型MVB和外泌体的生成,但是其具体的调节机制仍不是很清晰。根据该家族蛋白的特性和研究结果,研究者们提出的假说是四次跨膜家族蛋白与较多蛋白质存在相互作用,并且该类蛋白质之间同样容易形成多聚复合物,因此倾向于在内吞体膜上团聚成簇,形成所谓的"四次跨膜蛋白富集微结构域",从而可以有效促进其他货物蛋白在内吞体膜上的分选富集和ILV形成[8]。
展望
尽管目前关于MVB生成的研究很多,也揭示了许多介导ILV形成的调控因子和作用机制,但MVB领域仍然存在很多未被解决的问题。比如,上述三大类机制之间是否存在协同调控,ESCRT组分在调控ILV形成过程中是否也通过影响脂类或四次跨膜蛋白来实现或者反之?另外,货物分子本身是否也决定内吞体膜上内陷形成的时间和位置?以及MVB降解或分泌的命运是如何决定和调控的?未来这些问题的回答都将加深我们对这一领域的理解。
参考文献:
1. Hanson P I, Cashikar A. Multivesicular body morphogenesis. Annu Rev Cell Dev Biol, 2012, 28: 337-362
2. Colombo M, Raposo G, Thery C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu Rev Cell Dev Biol, 2014, 30: 255-289
3. Teng F, Fussenegger M. Shedding light on extracellular vesicle biogenesis and bioengineering. Adv Sci (Weinh), 2020, 8(1): 2003505
4. Vietri M, Radulovic M, Stenmark H. The many functions of ESCRTs. Nat Rev Mol Cell Biol, 2020, 21(1): 25-42
5. Henne W M, Buchkovich N J, Emr S D. The ESCRT pathway. Dev Cell, 2011, 21(1): 77-91
6. Trajkovic K, Hsu C, Chiantia S, et al. Ceramide triggers budding of exosome vesicles into multivesicular endosomes. Science, 2008, 319(5867): 1244-1247
7. Kowal J, Tkach M, Thery C. Biogenesis and secretion of exosomes. Curr Opin Cell Biol, 2014, 29: 116-125
8. Hessvik N P, Llorente A. Current knowledge on exosome biogenesis and release. Cell Mol Life Sci, 2018, 75(2): 193-208
9. Kajimoto T, Mohamed N N I, Badawy S M M, et al. Involvement of Gβγ subunits of Gi protein coupled with S1P receptor on multivesicular endosomes in F-actin formation and cargo sorting into exosomes. J Biol Chem, 2018, 293(1): 245-253
作者简介:

施雷玲
博士期间师从于中科院生物物理所王晓晨研究员,研究方向为微丝骨架交联蛋白调控多囊泡体生成的机制探究。目前就职于纽英伦生物技术(北京)有限公司。
 附件下载:
附件下载: