纳米抗体--是什么?新在哪?
抗体是一种免疫球蛋白,大多数动物和人类体内的IgG抗体为由轻链和重链组成的Y形结构,分子质量一般在150 ku左右。纳米抗体是科学家1989年发现的一种来源于骆驼科动物体内、天然缺失轻链的重链抗体可变区,分子质量只有15 ku,是常规抗体分子质量的1/10。其蛋白质晶体结构长度为4 nm,直径为2.5 nm,是目前已知分子质量最小的抗体,因此称之为纳米抗体(图1)。相比于传统抗体,纳米抗体的活性结合区域较长,氨基酸数量多达16~18个,且其温度稳定性及有机溶剂耐受性更强,部分还可耐受蛋白酶,也能耐受更广的酸碱范围(传统抗体仅耐受pH6~9,纳米抗体可耐受pH2~11)。此外,纳米抗体的制备方式为工程菌表达,不同于传统抗体的杂交瘤细胞制备方式,因此也具有易表达、易于基因工程改造的优点。基于其稳定性、穿透力等方面的优势,目前纳米抗体在疾病治疗、诊断及物质检测等领域广受关注。
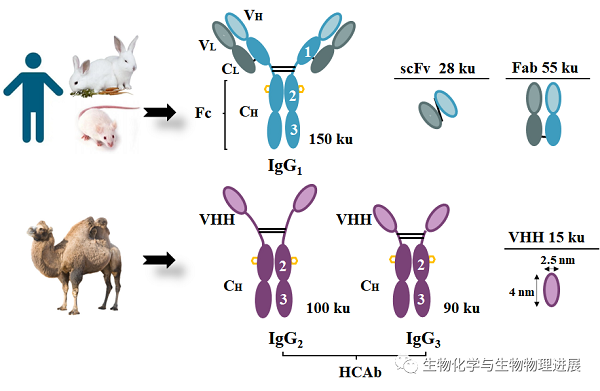
图1 传统抗体与骆驼源纳米抗体的结构与分子质量比对
性能优势--到底优在哪里?
01 相对分子质量小而抗原结合活性强
纳米抗体比常规抗体小那么多,其对抗原的结合活性是否不如常规抗体呢?事实并非如此,纳米抗体虽然体积尺寸小,但却具有亲本抗体的完整抗原结合活性。纳米抗体对抗原的高亲和性来自于其独特的蛋白质结构。
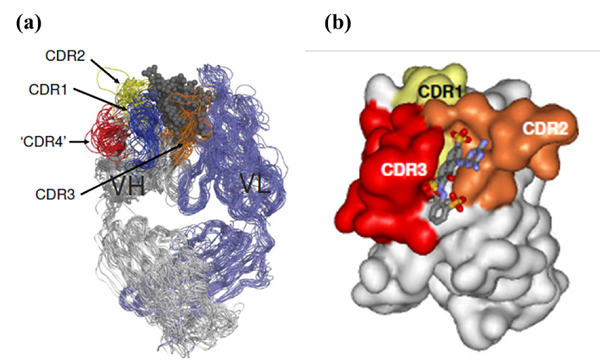
图2 传统抗体与纳米抗体的活性结合部位比对[1](a)传统抗体抗原结合位点展示;(b)纳米抗体CDR 环及结合部位构象展示
纳米抗体结构及活性部位如图2所示,其只有3个高度可变区域(CDR1/CDR2/CDR3)。由于纳米抗体的CDR3长度比一般抗体的CDR3长,在一定的程度上弥补了因轻链缺失而造成的结合力下降,从而使其具有较强的抗原结合能力[2]。并且,纳米抗体不含有多余冗杂结构,仅保留了最关键的抗原结合活性部位,这些部位被保守的框架区域(非高度可变区域FR1/FR2/FR3/FR4)所包围,形成了形状较小的凸状、凹槽状或口袋状等空腔,可以优先识别裂口[3],并结合这些隐藏和凹陷的抗原表位,这也是常规抗体难以识别的表位,因此,具备上述抗原结合活性是纳米抗体相较于常规抗体特有的一大优势,这也是它分子质量小但抗原结合活性强、不亚于常规抗体的原因。
02 稳定性高
常规传统抗体稳定性较差,然而纳米抗体的稳定性却非同一般,主要归因于其内部存在额外的二硫键。在常规抗体中,形成环间二硫键的现象极少,而在纳米抗体中却较为普遍。基于二硫键不易断裂,构象不易发生改变,所以纳米抗体往往相对常规抗体更耐高温和高浓度的有机溶剂。
基于此优势,就可以预想到纳米抗体高稳定性特点在其应用环境中的重要性了。在抗体在生产应用过程中,有多种因素导致抗体蛋白结构发生诱导变性,包括温度、有机溶剂、压力、化学试剂、酸碱环境以及蛋白酶等。部分纳米抗体可以在-20 ℃、4 ℃条件下保存几个月,甚至在 37 ℃条件下保存几个月到一年也不会丢失其抗原结合活性[4],这种长期稳定性使其能在室温下运输、储存和使用。纳米抗体区别于常规抗体的重要特点是其在极端温度下的可逆性[5]。这种可逆性可以通过检测高温孵育一段时间后纳米抗体的活性来进行表征(图3)。通过总结部分已报道的纳米抗体性能检测情况发现,大部分纳米抗体在 85 ℃高温长时间处理后仍可保持结合活性,而常规抗体则不可逆地失活[6-10]。
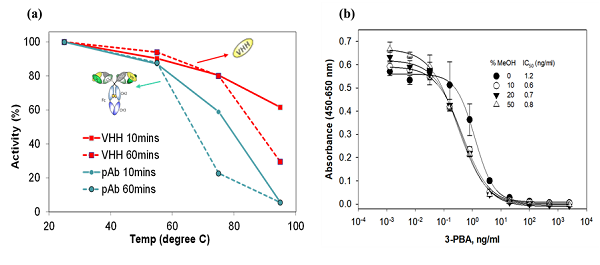
图3 纳米抗体稳定性能探究(a)传统抗体与纳米抗体在不同温度下的活性展示[8](b)纳米抗体在不同浓度有机溶剂下的ic-ELISA活性展示[9]
03 水溶性好
相对于传统抗体,纳米抗体FR2区的4个脂肪族氨基酸残基被亲水性氨基酸取代,使得亲水性大幅提高,且部分FR2被拉伸扭转的CDR3环覆盖,避免与外界水环境的接触[11],从而防止纳米抗体的二聚化。因此,相比于常规抗体,纳米抗体的水溶解性更好,表达量通常也较高。
04 穿透力强
纳米抗体分子质量小、体积小,可瞬间穿透细胞进入胞内,高效捕获相关病原。这也是体积较大穿透力不够强的常规抗体所难以实现的。
制备流程--如何制备?只需学会这几招!
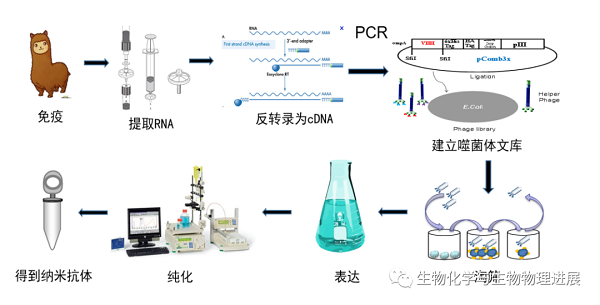
图4 纳米抗体制备流程
第一步:设计抗原免疫驼源动物。简单来说,就是以大分子或小分子结构为基础设计半抗原,并偶联蛋白制成抗原去免疫驼源动物,一般要免疫4~5次。第二步:提RNA建库淘筛。即先取血,提取血中淋巴细胞中RNA,反转录为cDNA,再进行PCR扩增,电转化至感受态细胞后建立噬菌体文库,经噬菌体展示技术得到多株阳性克隆。
第三步:阳性克隆的表达纯化。用icELISA检测方法检板确定其抗原结合活性及抑制率后进行存菌、大量表达纯化既得纳米抗体活性蛋白。最后建立相应检测方法评估所得纳米抗体的抗原结合特异性、稳定性等各方面性能并进行应用。
应用广泛--主要在哪些领域?如何应用?
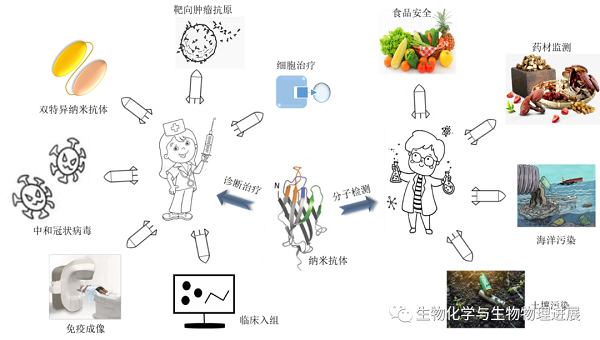
图5 纳米抗体的广泛应用
01 为何在诊断与治疗中被寄予厚望?
在疾病诊断与治疗方面,纳米抗体具有易渗透、快速肾脏清除的优势,可用荧光探针、酶示踪剂、生物素等分子进行标记作为示踪剂,与分子成像技术相结合从而优化成像系统,成为体外和体内成像的理想选择[12]。加上其分子质量小、穿透力强、灵敏度高、特异性强,当它进入体内后,可高效穿透细胞来快速捕获抗原、中和病毒以达到治疗目的。在中枢神经系统疾病、循环系统疾病、感染性疾病、肿瘤和炎症性疾病中纳米抗体也表现出优异的应用价值和前景,相关研究主要聚焦于肿瘤治疗且已取得了显著成效,为患者带来新的希望。单克隆抗体虽然也被用于肿瘤成像领域,但由于其较弱的肿瘤穿透能力和较长的血清半衰期,在进行肿瘤成像时很难形成高对比度的图像,因此在一定程度上限制了它的使用。而纳米抗体分子质量小,更容易渗透到肿瘤组织中,因此纳米抗体用于肿瘤成像可以检测到更多的靶点分布,同时,纳米抗体由于半衰期短,在人体内停留时间较短,这也避免了其在肿瘤成像中的系统性分布,因此纳米抗体在给药后不久便可以产生较高的肿瘤/背景比。此外,纳米抗体可作为治疗动、植物病毒感染的理想工具,对病原的传播及时做出干预和控制。目前多数研究者还利用相同或不同的纳米抗体构建了多价、多特异性纳米抗体进行高效治疗,实现了提高捕获效率或同时捕获不同对象的目的。
基于纳米抗体对环境条件适应力强、变性后还可有效重折叠并恢复其抗原亲和力[5]的优势,在医疗中可适用于多种给药途径,包括静脉和皮下注射、鼻吸入和口服等,比如最新分离出的可有效中和冠状病毒SARS-CoV-2的纳米抗体可以在冻干和气雾化后保持稳定不聚集且具有较高的亲和力,可作为制备预防和治疗新冠肺炎的鼻腔喷雾剂和雾化吸入疗法的潜在药物[13]。此外,纳米抗体还可作为结晶伴侣,通过调整抗体空间构象来稳定药物配体、诱导抑制剂的结合以增强抑制作用等。因此,具备上述功效的纳米抗体堪称新一代"生物技术导弹"。
02 在食品安全检测领域发挥强大功能
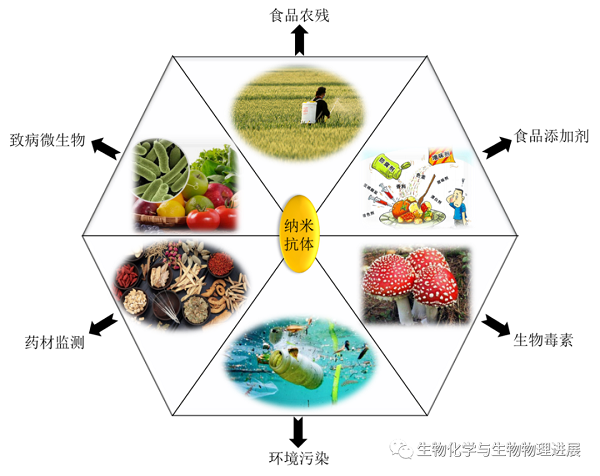
在食品安全检测领域,纳米抗体主要可在农药兽药残留领域、食品添加剂、生物毒素、致病微生物以及环境污染等多个方面发挥作用。目前已结合基因工程和蛋白质工程等手段开发针对农作物或食品中的各类农药及其代谢物、毒素检测的特异性纳米抗体,比如检测果蔬中的农药杀螟硫磷纳米抗体、检测韭菜中的农药腐霉利纳米抗体、检测农药代谢物3-苯氧基苯甲酸纳米抗体以及1-萘酚纳米抗体等,同时表征了其稳定性能。并通过建立多种方法如常规酶联免疫吸附法、免疫层析试纸条、生物素化以及荧光免疫检测技术等来验证其高灵敏度,以期更好更广泛地应用于食品安全中。然而,随着国家标准的不断更新以及食品安全质量要求的提高,部分纳米抗体未能达到期待的微量检测效果,要么抗原结合特异性不高,要么稳定性能较差。因此,为了使其更全面发挥功能,建议采用基因工程手段干预进化以提高纳米抗体的稳定性。
目前已有很多研究者通过定点突变、引入二硫键等基因工程方法制备出相对亲本更稳定的纳米抗体,但是此方法也会对纳米抗体的应用性能产生一定的影响,包括复性能力[3, 14]、亲和力以及特异性[15]等,还可能形成错误的二硫键而影响抗体表达量等[16]。因此,在进行抗体的二硫键工程化时应该综合考虑稳定性、亲和力与表达量等方面的影响。此外,大多数的工程化是基于共有序列的分析与经验值的基础,很少涉及晶体结构的分析,这会导致得出的稳定性结构信息具有一定的片面性,因而经常导致其对表达量与亲和力等其他性能产生不利的影响。一般来说,以高浓度纳米抗体制备晶体对纳米抗体的有效进化具有较高的理论指导。目前,本实验室[9]成功获得纳米抗体蛋白晶体,通过X-射线衍射技术解析获得准确的三维结构。并通过比对未加配体和添加配体的电子云密度图,这样即可清晰地显示加入配体的位置。
总体来说,蛋白质晶体的制备与结构解析是研究蛋白质结构最直观准确的技术,明确重链抗体识别方式、关键氨基酸残基、结合位点、作用力类型等关键信息,是全面探讨纳米抗体的一级序列结构、二级折叠结构、三级空间结构与稳定性的关系与规律的重要手段,也是未来深入探究抗原抗体之间分子相互作用机理以应用于实际蛋白质进化、实际样品检测的重要研究方向。只有深入解析纳米抗体结构,明确它们与抗原之间的相互作用,才能进行有效干预,生产出综合性能更强的能实现超微量检测的纳米抗体以适应当前食品质量安全要求的不断提高。
结语与展望
纳米抗体分子质量小,结构简单,基于其水溶性高、稳定性强、穿透力强等特点,在临床诊断治疗领域可极速捕获病毒抗原,高效阻断病原传播,成为继单克隆抗体之后的新一代"生物技术导弹"。然而,虽说纳米抗体较传统抗体更具优势,但依然存在一些局限性。一方面,用于开发纳米抗体的重链抗体目前只能从驼类动物或者鲨鱼科中获取,而传统的单克隆抗体从常用的小鼠体内便可获得;另一方面,现已报道的生产纳米抗体的方法在抗体产量、亲和性和降低生产成本方面依然具有较大的改进空间,尤其是部分具有额外二硫键的序列,表达难度更高。因此,克服这些局限性、促进纳米抗体大批量低成本生产将成为后续研究的重要方向之一,由于具有额外二硫键的纳米抗体稳定性高,复性容易,因此以包涵体形式表达或许可成为该类纳米抗体大批量生产的有效途径。
未来纳米抗体在结构生物学方面以及应用于复杂基质与环境的检测等方面也具有较为广阔的前景。尤其是在纳米抗体的结构与稳定性关系方面,尚存在许多不明确的潜在机理,值得进行深入的系统研究,为成功解析结构与稳定性内部机制以充分发挥纳米抗体功能,未来利用分子模拟技术与X射线衍射晶体技术等也将成为主要的研究方向之一。(详情请点击阅读原文)
参考文献
[1] Fanning S, Horn J. An anti-hapten camelid antibody reveals a cryptic binding site with significant energetic contributions from a nonhypervariable loop. Prot Sci, 2011, 20 (7): 1196-1207
[2] Cai H, Yao H, Li T, et al. An improved fluorescent tag and its nanobodies for membrane protein expression, stability assay, and purification. Commun Biol, 2020, 3(1): 753
[3] Li C, Tang Z O, Hu Z X, et al. Natural single-domain antibody-nanobody: a novel concept in the antibody field. J Biomed Nanotechnol, 2018, 14(1): 1-19
[4] Akazawa-Ogawa Y, Takashima M, Lee Y H, et al. Heat-induced irreversible denaturation of the camelid single domain VHH antibody is governed by chemical modifications. J Biol Chem, 2014, 289(22): 15666-15679
[5] Goldman E R, Liu J L, Zabetakis D, et al. Enhancing stability of camelid and shark single domain antibodies: an overview. Front Immunol, 2017, 8: 865
[6] Anderson G P, Liu J L, Hale M L, et al. Development of antiricin single domain antibodies toward detection and therapeutic reagents. Anal Chem, 2008, 80(24): 9604-9611
[7] Tabares-Da Rosa S, Rossotti M, Carleiza C, et al. Competitive selection from single domain antibody libraries allows isolation of high-affinity antihapten antibodies that are not favored in the llama immune response. Anal Chem, 2011, 83(18): 7213-7220
[8] Graef R R, Anderson G P, Doyle K A, et al. Isolation of a highly thermal stable lama single domain antibody specific for Staphylococcus aureus enterotoxin B. BMC biotechnol, 2011, 11:86
[9] Bever C R, Majkova Z, Radhakrishnan R, et al. Development and utilization of camelid VHH antibodies from alpaca for 2,2',4,4'-tetrabrominated diphenyl ether detection. Anal Chem, 2014, 86(15): 7875-7882
[10] Kim H J, McCoy M R, Majkova Z, et al. Isolation of alpaca anti-hapten heavy chain single domain antibodies for development of sensitive immunoassay. Anal Chem, 2012, 84(2): 1165-1171
[11] Melarkode Vattekatte A, Shinada N K, Narwani T J, et al. Discrete analysis of camelid variable domains: sequences, structures, and in-silico structure prediction. Peer J, 2020, 8: e8408
[12] Vincke C, Muyldermans S. Introduction to heavy chain antibodies and derived nanobodies. Methods Mol Biol, 2012, 911:15-26 [
13] 孙山,谭星,庞晓燕,等. 纳米抗体技术应用的最新进展. 生物工程学报, 2022, 38(3):855-867
[14] Akazawa-Ogawa Y, Uegaki K, Hagihara Y. The role of intra-domain disulfide bonds in heat-induced irreversible denaturation of camelid single domain VHH antibodies. J Biochem, 2016, 159(1): 111-121
[15] Hussack G, Hirama T, Ding W, et al. Engineered single-domain antibodies with high protease resistance and thermal stability. PLoS One, 2011, 6(11): e28218
[16] Govaert J, Pellis M, Deschacht N, et al. Dual beneficial effect of interloop disulfide bond for single domain antibody fragments. J Biol Chem, 2012, 287(3): 1970-1979
作者简介
刘敏玲:华南农业大学食品学院博士研究生,研究方向为食品安全检测及相关抗原抗体结合机制研究。
徐振林:华南农业大学食品学院教授,工学博士,研究方向为食品安全与控制。
(作者:刘敏玲、何晓婷、王弘、沈玉栋、徐振林)
(本文来源于公众号: 生物化学与生物物理进展)
 附件下载:
附件下载: