根据世界卫生组织国际癌症研究机构(IARC)发布的2020年全球最新癌症负担数据发现,乳腺癌新增人数达226万,肺癌为220万,乳腺癌正式取代肺癌,成为全球第一大癌症(图1)。在中国癌症情况中,乳腺癌的发病率和死亡率也有所增长(图2)。乳腺癌越来越值得人们重视。与正常细胞相比,癌细胞的代谢特征发生了巨大的变化,不仅表现出对葡萄糖和谷氨酰胺有异常高的需求,而且脂质代谢也发生较大改变,如脂肪生成升高、脂肪酸摄取增加等。其中脂质代谢对乳腺癌细胞的影响尤其大,因为乳腺癌细胞通常被大量的脂肪细胞包围并产生一个富含脂肪酸的微环境,可作为细胞生长的外部刺激因素【1】。
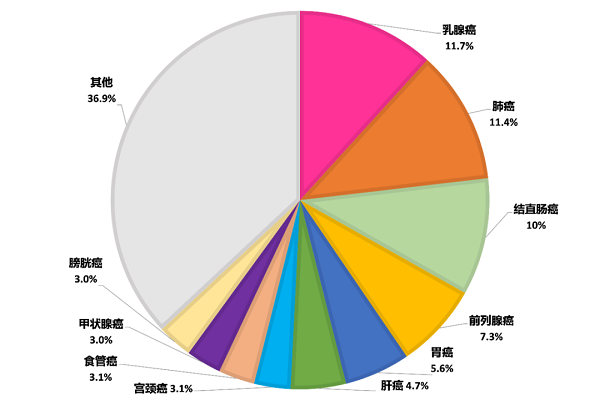
图1 2020年癌症新发病例数前十的癌症类型(https://www.iarc.who.int/fr/)

图2 2020年中国和全球癌症新发病例数前十的癌症类型(https://www.iarc.who.int/fr/)
脂质是人体需要的重要营养素之一,脂质分子主要包括脂肪酸、甘油酯和类脂三类,是生物膜的关键组分,参与多种重要生命活动。脂肪酸是合成甘油三酯的主要组成部分,甘油三酯主要用于能量存储。甘油三酸酯与甾醇和鞘脂一起代表生物膜的主要结构成分。脂质在信号传递,充当第二信使和激素方面也可以发挥重要作用。脂质代谢重编程在乳腺癌发生发展中的作用日益受到大家的关注和重视。
在大多数人体组织中,细胞对脂肪酸的需求一般是通过利用膳食中的脂肪酸来满足的,脂肪酸从头合成的途径是不重要的,但例外的是肝脏和乳腺,其次是脂肪组织。脂肪酸从头合成途径在正常组织与癌症组织中的重要性不同,使其成为一个有吸引力的治疗目标【2】。参与脂肪酸合成和氧化的关键代谢酶在乳腺癌细胞的增殖,迁移和侵袭中起着关键作用。其可以通过影响肿瘤细胞的活力,抑制乳腺癌细胞增殖、侵袭和转移【3】;通过影响细胞凋亡,阻止细胞周期和防止迁移来控制乳腺癌细胞的增殖【4】;通过影响一些代谢物形成激活致癌信号。并且肿瘤细胞中脂质代谢与肿瘤微环境有着极其密切的交互作用,外源性脂肪酸会促进癌症进展和生存【5】(图3)。
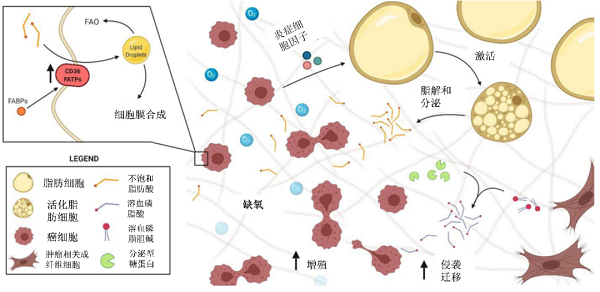
图3 来自肿瘤微环境的外源性脂肪酸促进癌症进展和生存【5】
细胞需要对环境作出适当的反应,才能使其生存、维持和生长。细胞外信使分子与同种细胞受体结合,将外界刺激传递到细胞内部。受体的激活引发一系列下游信号事件,导致基因表达的改变。这种将细胞外信号转导到细胞核的过程在癌细胞中是失调的。研究发现甾醇调节因子结合转录因子(sterol regulatory element binding transcription factor, SREBP)可调控脂肪酸、胆固醇代谢,许多原癌信号通路可以靶向调控SREBP,将癌变与脂代谢联系起来【6】(图4)。
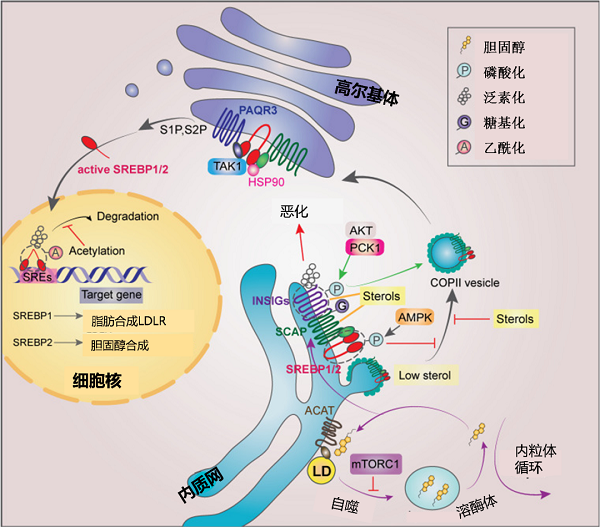
图4 肿瘤脂质合成代谢分子调控网络【6】
Notch信号是通过Notch配体与Notch受体的结合而启动的,是由细胞与细胞之间的接触介导的。Notch信号通路活化可促进乳腺癌的发生【7】。胆固醇外流调控Notch1的启动子,在转录水平上调控Notch信号通路的活性,进而调控造血干细胞的形成和分化【8】。SREBP和戊二烯酸盐途径可以调控Hippo信号通路活性,对于乳腺癌细胞的增殖有重要作用【9】。脂质代谢可以调节Hedgehog信号通路【10】,胆固醇能共价修饰Hedgehog及其下游的Smo蛋白【11】,氧化胆固醇可以激活Smo从而激活Hedgehog信号通路【12】。Wnt信号通路与癌细胞的代谢重编程有关【13】,β-catenin在乳腺癌细胞的代谢和能量平衡调节中起重要作用【14】,Wnt信号通路持续激活导致脂肪积累【15】。 mTOR调节SREBP和其他脂质代谢调节器和效应,mTOR抑制剂可以阻断与脂肪生成有关的基因的表达,并阻止SREBP的核积聚【16】。这些癌症干细胞相关信号途径都与脂质代谢重编程有着密切的关系(图5)。
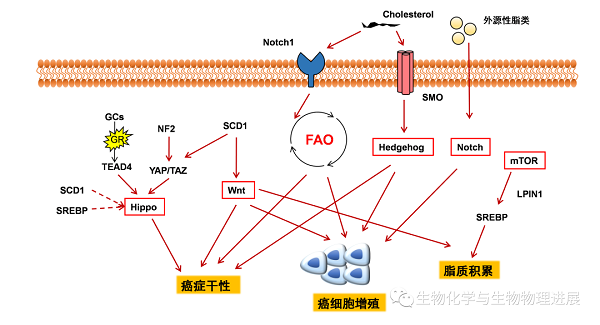
图5 Notch、Hippo、Hedgehog、Wnt、mTOR信号通路对脂代谢的调控
脂质代谢重编程是乳腺癌细胞的一大特征,脂质代谢的改变与乳腺癌等癌症的发生发展有关。乳腺癌细胞利用脂质代谢获取癌细胞增殖、存活、侵袭、转移以及对肿瘤微环境和癌症治疗响应所需要的能量、生物膜成分和所需的信号分子。同时脂质代谢重编程会改变乳腺癌细胞中的致癌信号通路,并通过包括脂质在内的分泌成分影响邻近的正常细胞群。这种复杂性说明不仅需要研究乳腺癌细胞中的脂质代谢网络,还需要研究肿瘤微环境中脂质代谢重编程对乳腺癌进展和治疗反应的影响。仍需深入探索脂质代谢重编程在乳腺癌中的肿瘤特异性调控,寻找乳腺癌诊断和治疗潜在的新的靶点。(详情请点击阅读原文)
参考文献
[1] Song L, Liu Z, Hu H H, et al. Proto-oncogene Src links lipogenesis via lipin-1 to breast cancer malignancy. Nat Commun, 2020 Nov 17;11(1):5842
[2] Snaebjornsson M T, Janaki-Raman S, Schulze A. Greasing the wheels of the cancer machine: the role of lipid metabolism in cancer. Cell Metab, 2020, 31(1):62-76
[3] Hatzivassiliou G, Zhao F, Bauer D E, et al. ATP citrate lyase inhibition can suppress tumor cell growth. Cancer Cell, 2005, 8(4):311-321
[4] Zhao J, Zhi Z, Wang C, et al. Exogenous lipids promote the growth of breast cancer cells via CD36. Oncol Rep, 2017, 38(4): 2105-2115
[5] Corn K C, Windham M A, Rafat M. Lipids in the tumor microenvironment: from cancer progression to treatment. Prog Lipid Res, 2020, 80:101055
[6] Bian X, Liu R, Meng Y, et al. Lipid metabolism and cancer. J Exp Med, 2021, 218(1):e20201606
[7] Demarest R M, Ratti F, Capobianco A J. It's T-ALL about Notch. Oncogene, 2008, 27(38):5082-5091
[8] Gu Q, Yang X, Lv J, et al. AIBP-mediated cholesterol efflux instructs hematopoietic stem and progenitor cell fate. Science, 2019, 363(6431):1085-1088
[9] Sorrentino G, Ruggeri N, Specchia V, et al. Metabolic control of YAP and TAZ by the mevalonate pathway. Nat Cell Biol, 2014, 16(4):357-366
[10] Xiao X, Tang J J, Peng C, et al. Cholesterol modification of smoothened is required for hedgehog signaling. Mol Cell, 2017, 66(1):154-162.e10
[11] Qi X, Liu H, Thompson B, et al. Cryo-EM structure of oxysterol-bound human Smoothened coupled to a heterotrimeric Gi. Nature, 2019, 571(7764):279-283
[12] Yu Q C, Verheyen E M, Zeng Y A. Mammary development and breast cancer: a Wnt perspective. Cancers (Basel), 2016, 8(7):65
[13] El-Sahli S, Xie Y, Wang L, et al. Wnt signaling in cancer metabolism and immunity. Cancers (Basel), 2019, 11(7):904
[14] Vergara D, Stanca E, Guerra F, et al. β-catenin knockdown affects mitochondrial biogenesis and lipid metabolism in breast cancer cells. Front Physiol, 2017, 8:544
[15] Chen M, Lu P, Ma Q, et al. CTNNB1/β-catenin dysfunction contributes to adiposity by regulating the cross-talk of mature adipocytes and preadipocytes. Sci Adv, 2020, 6(2):eaax9605
[16] Porstmann T, Santos C R, Griffiths B, et al. SREBP activity is regulated by mTORC1 and contributes to Akt-dependent cell growth. Cell Metab, 2008, 8(3):224-236
作者简介
张红胜:北京工业大学环境与生命学部,教授。研究方向为肿瘤代谢。
王淼:北京工业大学生物医学工程专业硕士研究生,军事医学科学院联合培养研究生。研究方向:病原体即时检测技术。
(作者:王淼、张红胜)
(本文来源于公众号: 生物化学与生物物理进展)
 附件下载:
附件下载: