帕金森病(Parkinson's disease,PD)、阿尔茨海默病(Alzheimer's disease,AD)、亨廷顿病(Huntington's disease,HD)、肌萎缩侧索硬化症(Amyotrophic lateral sclerosis,ALS)、孤独症谱系障碍(Autism spectrum disorder, ASD)等神经系统疾病,因缺乏有效治愈手段,严重影响人们的生活质量,给家庭和社会造成了巨大的精神压力和经济负担,已成为整个社会需要解决的问题。该类疾病发病机制复杂,目前尚未完全阐明,建立有关的动物模型对于阐明其病因、发病机制以及药物筛选具有重要意义。灵长类动物在遗传、行为、认知、生理、生化和解剖结构等生物学特性与人类比较接近,具有高级的脑功能结构及神经活动的优势,高度发达的前额叶皮质控制着高级认知功能是其他实验动物不可替代的,能回答各种分子细胞机理是否在整体水平上表现出类似于人类的生物学问题以及疾病特征和过程,是最理想的人类神经系统疾病动物模型,研究的结果更容易推广应用到人。常被用于建立神经退行性疾病、精神性疾病等疾病的动物模型,研究其致病机理、治疗及药物研发等。但灵长类动物生长周期长,传统的造模方法不太适合该类疾病整个病程发生发展的研究。随着CRISPR/Cas9基因编辑技术的问世与迅速发展,在创建人类疾病灵长类动物模型方面取得了重大进展,与转基因技术造模相比,能在较短时间内获得神经系统疾病灵长类动物模型,加快相关疾病动物模型的创建工作。
CRISPR/Cas9基因编辑技术是一种由RNA指导的Cas核酸酶对靶向基因进行特定DNA修饰的技术,是近年来发展迅速的一项基因定点编辑技术。CRISPR/Cas9最早是在细菌中发现的一种适应性免疫防御机制,某些细菌在遭到病毒入侵后,能够把病毒基因的一小段存储到自身的 DNA 里一个称为 CRISPR 的存储空间,当再次遇到病毒入侵时,细菌能够根据存写的片段识别病毒,利用Cas9核酸酶对外源DNA进行切割从而保护自身基因完整性。CRISPR/Cas9系统是由规律成簇的间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)和具有切割DNA 双链作用的Cas9蛋白(CRISPR-associated protein 9)组成。CRISPR基因序列主要由前导序列(leader)、重复序列(repeat)和间隔序列(spacer)构成,前导序列是CRISPR序列的启动子,重复序列用来稳定RNA的整体二级结构,间隔序列是被细菌俘获的外源DNA序列,当这些外源遗传物质再次入侵时,CRISPR/Cas系统就会予以精确打击。CRISPR可指导Cas9蛋白对目的序列的匹配。Cas9蛋白具有切割DNA 双链作用,主要参与crRNA的成熟以及降解入侵的噬菌体 DNA 或是外源质粒【1】。
CRISPR/Cas9系统工作原理:CRISPR捕获外源质粒DNA的一小段DNA 序列后,CRISPR被转录为crRNA(RISPR RNA,crRNA),与其重复序列互补的反式激活crRNA(trans-activating crRNA, tracrRNA)也转录出来,crRNA和tracrRNA通过局部碱基配对组成sgRNA(single guide RNA),sgRNA与Cas9蛋白结合后引导Cas9蛋白识别和切割目标DNA序列。通过人工设计这两种RNA,可以改造形成具有引导作用的sgRNA,可引导Cas9对DNA的定点切割。
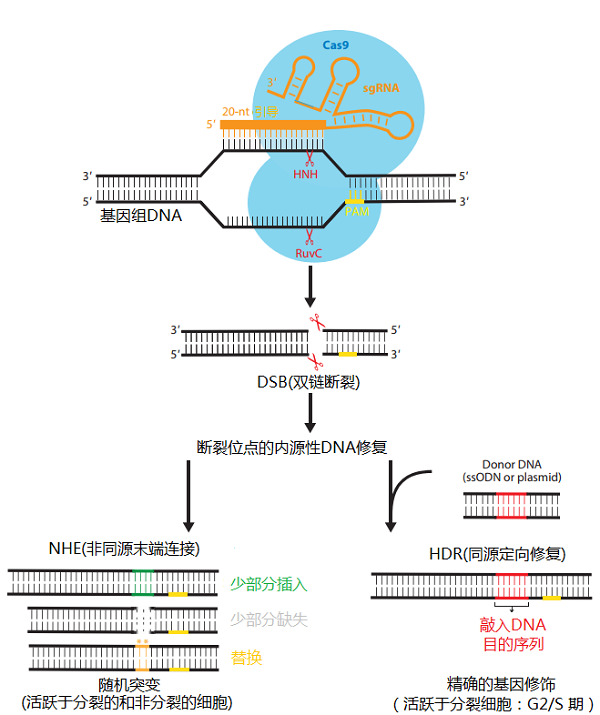
CRISPR/Cas9基因编辑技术【1】
其应用范围包括基因敲除、基因敲入、基因抑制/激活、基因多重编辑、功能基因组筛选。
基因敲除(Knock-out) :CRISPR/Cas9系统可利用Cas9蛋白对靶基因组进行剪切,使DNA双链断裂,进而实现基因敲除。基因敲入(Knock-in):当DNA双链断裂后,如果有DNA修复模板进入到细胞中,基因组断裂部分会依据修复模板进行同源重组修复(HDR),从而实现基因敲入。DNA 修复模板可以是线性/双链脱氧核苷酸链,也可以是双链DNA质粒。基因抑制/激活(Repression or Activation):Cas9具有独立切割和结合靶基因的能力,可通过点突变的方式使RuvC-和HNH-两个Cas9(dCas9)的结构域失活,形成的dCas9只能在sgRNA的介导下结合靶基因,而不具备剪切DNA的功能,将dCas9结合到基因的转录起始位点,可以阻断转录的启动,从而抑制基因表达;将dCas9结合到基因的启动子区域也可以结合转录抑制/活化物,使下游靶基因转录受到抑制或激活。基因多重编辑(Multiplex Editing):将多个sgRNA质粒转入到细胞中,可同时对多个基因进行编辑,具有基因组功能筛选作用。功能基因组筛选:利用CRISPR/Cas9进行基因编辑可产生大量的基因突变细胞,利用这些突变细胞可以确认表型变化是否是由基因或者遗传因素导致的。目前,CRISPR的基因组筛选功能应用于筛选对表型有调节作用的相关基因,如对化疗药物或者毒素产生抑制的基因、影响肿瘤迁移的基因以及构建病毒筛选文库对潜在基因进行大范围筛选等。
Li等【2】利用腺病毒介导的CRISPR/Cas9 系统分别编辑中、老年猴黑质中的PINK1和DJ-1基因,诱导出经典PD症状的中、老年食蟹猴模型,表现出运动迟缓、震颤、体位不稳等典型症状,并伴有关键病理改变,如严重的黑质多巴胺能神经元缺失(>64%)和基因编辑的黑质中有明显的α-syn病理变化。该方法在较短时间(6~10个月)内批量建模,为今后PD疾病的研究提供一种实用的转基因猕猴模型。
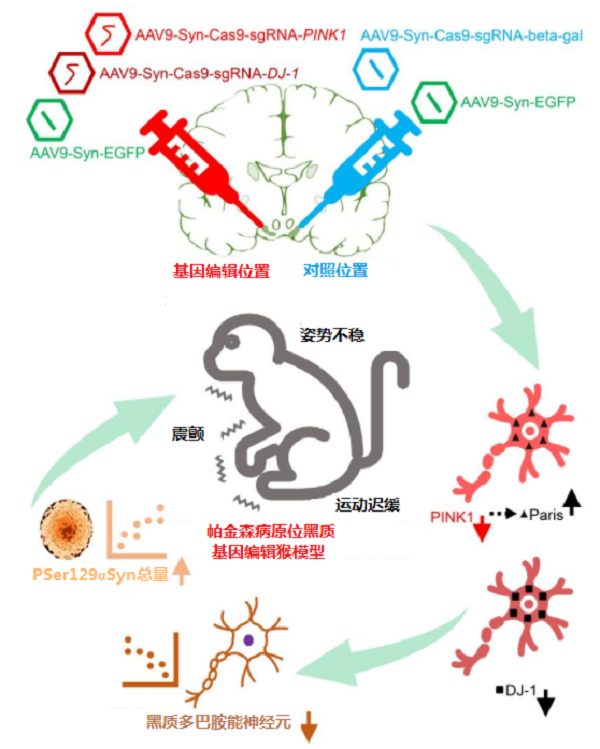
AAV9介导的CRISPR/Cas9基因编辑导致成年猕猴出现帕金森病核心表型【2】
Wu等【3】将携带CRISPR/Cas9的腺相关病毒特异地注射到青春期猕猴调控社交记忆的海马脑区,可编辑其海马脑区的MECP2,基因编辑的猕猴出现了社交障碍,睡眠节律紊乱等多种与孤独症患者核心症状十分相似的行为改变,但却没观察到刻板运动等另一部分孤独症核心症状,有可能不同的脑区在该疾病的发生发展中扮演着不同的角色。与主流的基于胚胎转基因技术构建的MECP2转基因灵长类动物模型【4-5】相比,此类模型制作可回避制作周期长、成功率低、成本高及嵌合体等问题。
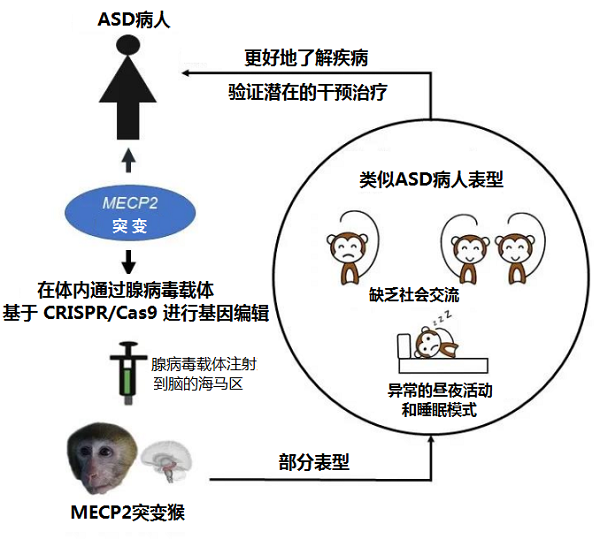
向猕猴海马脑区注射AAV病毒对MECP2基因进行编辑,成功诱导猕猴出现了部分ASD疾病的表型【3】
Chen等【6】使用CRISPR/Cas9技术靶向破坏猕猴的肌营养不良蛋白基因建立了杜氏肌营养不良( Duchenne musculardystrophy, DMD)猕猴模型,在模型早期观察到肌营养不良蛋白显著减少和肌肉退化,暗示疾病早期的治疗干预可能有效缓解该病。
CRISPR/Cas9基因编辑技术加速了分子生命科学的发展,使得研究人员能得心应手对遗传物质进行操作或修饰,是神经系统疾病灵长类动物模型的造模利剑,为灵长类动物在神经性疾病研究中的应用带来了新机遇,也有望催生创新性神经性疾病的治疗。(详情请点击阅读全文)
目前,中国科学院昆明动物研究所承担建设的世界上首个对灵长类动物表型与遗传进行全尺度研究、国际一流的大型"模式动物(灵长类) 表型与遗传研究国家重大科技基础设施"即将投入使用,为突破灵长类动物模型构建与应用相关技术瓶颈再添平台优势及保障。
参考文献
[1] Jiang F, Doudna J A. CRISPR-Cas9 Structures and Mechanisms. Annu Rev Biophys, 2017 46:505-529
[2] Li H, Wu S, Ma X, et al. Co-editing PINK1 and DJ-1 genes via adeno-associated virus-delivered CRISPR/Cas9 System in adult monkey brain elicits classical Parkinsonian phenotype. Neurosci Bull, 2021, 37(9): 1271-1288
[3] Wu S H, Li X, Qin D D, et al. Induction of core symptoms of autism spectrum disorder by in vivo CRISPR/Cas9-based gene editing in the brain of adolescent rhesus monkeys. Sci Bull, 2021, 66(9): 937-946
[4] Chen Y, Yu J, Niu Y, et al. Modeling Rett syndrome using TALEN-edited MECP2 mutant cynomolgus monkeys. Cell, 2017, 169(5): 945-955.e910
[5] Liu Z, Li X, Zhang J T, et al. Autism-like behaviours and germline transmission in transgenic monkeys overexpressing MeCP2. Nature, 2016, 530(7588): 98-102
[6] Chen Y, Zheng Y, Kang Y, et al. Functional disruption of the dystrophin gene in rhesus monkey using CRISPR/Cas9. Hum Mol Genet, 2015, 24(13): 3764-3774
作者简介
李乙江:博士,中国科学院昆明动物研究所工程师,从事国家非人灵长类实验动物资源库工作,主要研究方向为灵长类资源研究。
(作者:李乙江)
(本文来源于公众号: 生物化学与生物物理进展)
 附件下载:
附件下载: