自2020年诺贝尔化学奖颁发给开发了基因编辑工具的两位女科学家埃马纽埃尔·卡彭蒂耶(Emmanuelle Charpentier)和詹妮弗·杜德纳(Jennifer A. Doudna)以来,基因编辑逐渐步入大众的视野【1】。利用这一技术,科研人员可以在生物体基因组中更加高效地插入或删除某些基因,改变生物体的表型。基因编辑技术的一个重要应用是通过改变基因来获得各种疾病动物模型,能够帮助人们更好地去了解疾病发生的机理,进而去开发新的诊疗手段。

作为基因编辑的应用对象,动物模型是生命科学研究中不可或缺的重要工具,科学实验中常见的动物有果蝇、斑马鱼、小鼠等,其中小鼠是应用最广泛的哺乳动物模型。然而,由于小鼠的体型与人类存在巨大差距,许多在小鼠上颇有成效的试验,在人体上收效甚微,例如,95%左右的在小鼠上测试有效的肿瘤药物,在临床测试中宣告失败【2】。此外,很多人体上由于基因突变导致的疾病,在小鼠中突变相同的基因,表型不明显,甚至没有表型。以上现象都提示我们,小鼠作为动物模型并非十全十美。
猪不仅在农业生产中具有重要的经济价值,事实上,在科学研究领域,猪也大有用途。科研人员通过生物分析发现,猪不仅在体型大小、解剖结构、生理代谢上与人类更加相似,甚至在基因表达水平上也与人类有很大的相似性。可能有的人会说,猴子岂不是跟人更相似?为什么不用猴子做模型呢?确实,从进化上看,猴子与人更接近,确实也有一些科研人员在从事猴子相关的研究工作,然而用猴子作为动物模型进行研究,一方面经济成本高昂,很多实验室难以负担;另一方面,猴子的繁殖周期较长、产仔量少,生长周期长、时间成本过高。因此,科研人员将目光投向了猪,期望猪作为一种大动物模型能发挥其大动物的优势,同时降低实验成本。
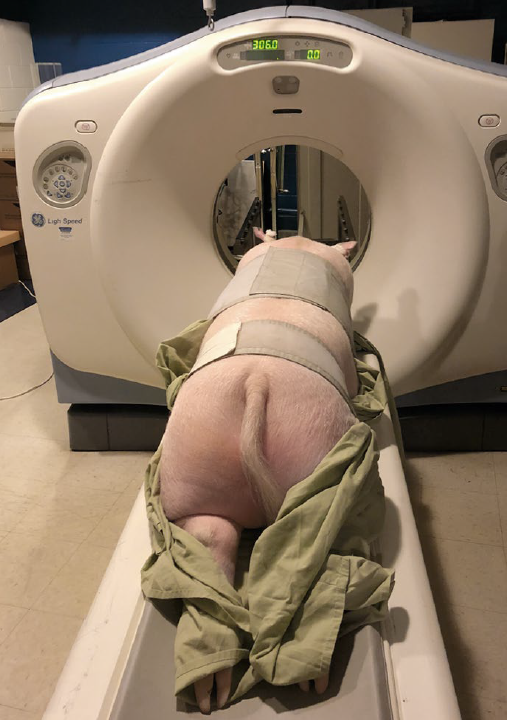
人类疾病诊疗的设备同样应用于猪【3】
在人类疾病模型建立上,猪确实可以实现小鼠上实现不了的事。在脑生命科学研究中,由于小鼠脑的结构比较简单,难以模拟人脑相关疾病,而猪脑与人脑的结构更为相似,有类似的脑回结构,更适合作为脑生命科学的动物模型。如人类亨廷顿舞蹈症是由于HTT基因1号外显子CAG重复导致蛋白质错误折叠和聚集,患者往往出现精神障碍、痴呆、动作不受控制,在基因修饰猪上出现了与人体类似的神经退行性特征【4】,然而在亨廷顿小鼠模型上没有明显的症状【5】。

亨廷顿基因编辑猪模型【4】
此外,在肺相关疾病模型的构建上,CFTR基因突变会导致人体出现肺部囊性纤维化,该基因突变的猪表现出明显的肺部缺陷【6】,但小鼠肺部没有明显病理变化【7】。像这样,小鼠上无法模拟人体病症的例子还有很多,例如在胰腺发育中发挥重要作用的GATA4和GATA6,两个基因中任意一个突变都会导致人体胰腺功能受损,从而出现糖尿病的表型,然而在小鼠中,只有将两个基因同时失活,才会导致小鼠胰腺发育缺陷【8-10】。这些都提示我们,小鼠和人之间的差异性,同时,我们也看到了猪作为疾病模型的闪光点。
在异种器官移植领域,猪凭借与人类器官更加相似的大小、生理结构,被认为是未来最有潜力的异种器官移植供体来源。异种器官移植中面临的最大困难是免疫排斥反应,基因编辑技术的高速发展使得科研人员能够通过对供体进行多种基因改造,从而降低供体的免疫原性。早在2002年,赖良学等【11】就培育出单等位α-1,3-半乳糖苷转移酶基因敲除猪来避免猪血管内皮中的α-1,3-半乳糖抗原与人血液中的抗体结合,从而降低猪作为供体时人体产生的超急性排斥反应。此外,由于猪体内存在内源性病毒,可能存在安全隐患,2017年,杨璐菡团队成功获得了猪内源性逆转录病毒敲除的基因修饰猪,提高了猪作为异供体来源的安全性【12】。2022年1月初,美国马里兰大学医学中心完成了世界上首例猪心脏移植到人的手术,移植后患者存活59天,开辟了基因编辑猪在异种器官移植领域的新纪元【13】。值得一提的是,此次作为供体的心脏来源于编辑了10个基因的基因编辑猪,使得患者在接受移植后没有立刻出现超急性排斥反应,这些得益于基因编辑技术的发展。未来,基因编辑工具的改造将极大推进猪在异种器官移植领域的广泛应用。
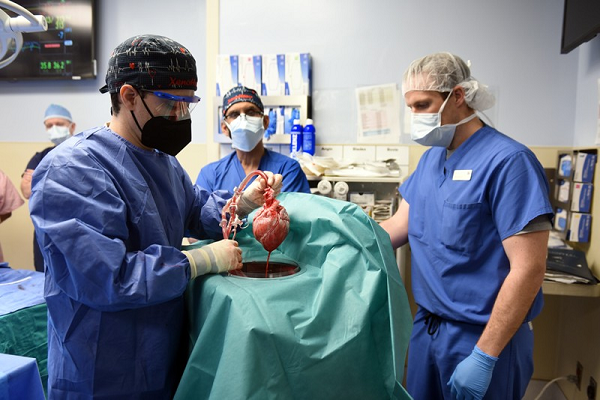
世界首例猪心脏移植到人体手术【13】
基因编辑技术作为科学研究的工具,使得科研工作者不仅能够高效快速地获得各类基因修饰动物,还能在特定时间、特定组织器官中控制基因表达,帮助人们更好地理解基因在不同生命阶段发挥的功能。作为基因编辑工具的应用对象,动物模型的选择至关重要,基因修饰猪将凭借其与人类更多的相似性、饲养成本相对较低,成为临床前优于啮齿类动物、廉于非人灵长类动物、不可或缺的高性价比大动物模型。(详情请点击阅读原文)
参考文献
[1] Jinek M, Chylinski K, Fonfara I, et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science, 2012, 337(6096): 816-821
[2] Hutchinson L, Kirk R. High drug attrition rates--where are we going wrong?. Nat Rev Clin Oncol, 2011, 8(4): 189-190
[3] Neff E P. Cancer modeling thinks big with the pig. Lab Anim (NY), 2019, 48(3): 75-78
[4] Yan S, Tu Z, Liu Z, et al. A Huntingtin knockin pig model recapitulates features of selective neurodegeneration in Huntington's disease. Cell, 2018, 173(4): 989-1002.e1013
[5] Levine M S, Cepeda C, Hickey M A, et al. Genetic mouse models of Huntington's and Parkinson's diseases: illuminating but imperfect. Trends Neurosci, 2004, 27(11): 691-697
[6] Meyerholz D K. Lessons learned from the cystic fibrosis pig. Theriogenology, 2016, 86(1): 427-432
[7] Grubb B R, Boucher R C. Pathophysiology of gene-targeted mouse models for cystic fibrosis. Physiol Rev, 1999, 79(1 Suppl): S193-214
[8] Carrasco M, Delgado I, Soria B, et al. GATA4 and GATA6 control mouse pancreas organogenesis. J Clin Invest, 2012, 122(10): 3504-3515
[9] Allen H L, Flanagan S E, Shaw-Smith C, et al. GATA6 haploinsufficiency causes pancreatic agenesis in humans. Nat Genet, 2011, 44(1): 20-22
[10] Xuan S, Borok M J, Decker K J, et al. Pancreas-specific deletion of mouse Gata4 and Gata6 causes pancreatic agenesis. J Clin Invest, 2012, 122(10): 3516-3528
[11] Lai L, Kolber-Simonds D, Park K W, et al. Production of alpha-1,3-galactosyltransferase knockout pigs by nuclear transfer cloning. Science, 2002, 295(5557): 1089-1092
[12] Niu D, Wei H J, Lin L, et al. Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9. Science, 2017, 357(6357): 1303-1307
[13] Reardon S. First pig-to-human heart transplant: what can scientists learn?. Nature, 2022, 601(7893): 305-306
作者简介
刘晓艺:中国科学院广州生物医药与健康研究院发育生物学博士研究生,研究方向为基因编辑工具改进以及在大动物疾病模型中的应用。
(作者:刘晓艺)
(本文来源于公众号: 生物化学与生物物理进展)
 附件下载:
附件下载: