药物,使我们拥有科学有效的方式去应对疾病,但药物是一把双刃剑,一旦误用有可能对机体造成严重的伤害,所以需要规范使用。规范的前提需要有标准,而标准的衡量则需要建立相应的药物评价体系去探索。可以说,每个上市的药物都经历了严谨、规范、有效的筛选才能被投入使用。其中,候选药物对心脏的毒副作用是其在开发过程中被淘汰的重要原因之一【1】,那么针对药物心脏毒性评价的心肌模型主要有哪些呢?

动物模型
目前,科学家常常采用小白鼠、兔子等动物模型进行药物毒性试验【2】,动物模型可克服药物毒性潜伏期长、诱发病程长等缺点,也可避免未知化合物对人体所带来的危害,但把药物按照同样方法作用于人体时,实验结果往往有所差别,其主要原因是动物体与人体存在固有的基因和生理结构等方面的种属差异,所以动物模型对药物的响应情况与临床实验结果有一定的差距【3】。

体外二维细胞模型
从人体提取心肌细胞用于体外模型的构建不具备可行性,况且心肌细胞具有不可再生性,无法满足科学研究对基础实验材料的大量需求。经过科研工作者的努力,发现了细胞界的"万能钥匙"--干细胞。干细胞的出现不仅克服了以上缺陷,而且通过给予一定的刺激,它可以分化为心肌细胞、内皮细胞、神经元等不同功能化细胞、组织,其自我增殖能力和多分化潜能对于体外心肌组织工程的构建研究具有重要意义【4】。
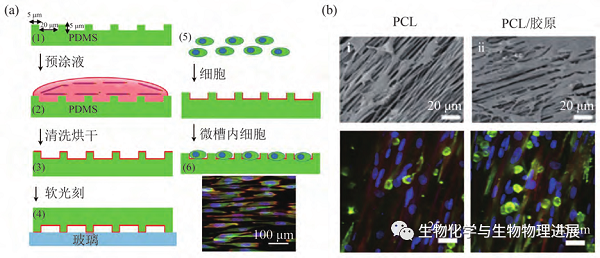
细胞培养模型常常借助于小小的培养皿、培养瓶或者培养板培养,操作方便、快捷,采用此方法培养的细胞是任意伸展生长的,与天然心肌特定取向性的生理特征不一致。因此,研究者开始尝试利用微纳加工、静电纺丝等各种工程技术实现具有特定取向排列的体外心肌模型构建。微图案加工技术(图a)是通过对材料基底表面形貌的精确控制,从而引导细胞沿表面形貌生长,以此实现对细胞排列方式和形态的调控【5】。静电纺丝技术(图b)是通过模仿天然细胞外基质(extracellular matrix,ECM)结构特征,结合纤维疏松多孔的结构实现心肌组织的取向排列【6】。
体外三维心肌组织模型
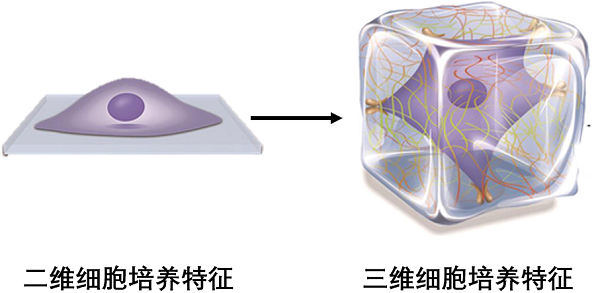
体外培养关注的不仅仅是细胞增殖生长,更重要的是实现机体微环境正常运作的仿生,只有内外环境的相互协同才能实现仿生模型的构建。随着组织工程的新兴发展,借助于生物打印技术、微流控技术的体外三维培养模型应运而生【7】。
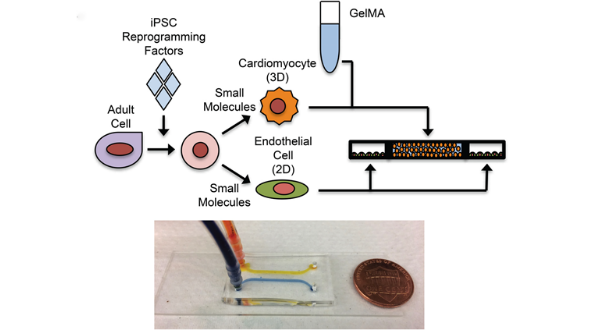
其中,生物打印技术是借助计算机辅助设计完全通孔、高度规则的支架材料并构建模拟体内心脏组织微环境的培养模型【8】。若体外心脏组织模型局限在静态的营养物质和药物传递,则无法模拟外周血管所提供的动态微循环环境,不能实现持续的营养供给和药物作用,从而导致药物测试结果与临床结果产生偏差。基于微流控技术的体外心脏模型在这方面表现出了良好的应用前景【9】。(具体构建方法介绍及优缺点对比请点击阅读原文)
心肌模型的未来在哪里?
目前,体外心脏模型在可视化诊疗【10】、药物筛选【11】、疾病诊疗【12】等方面取得了一系列研究成果。我们认为一个理想的体外药物评价心脏模型应具备以下几点:
细胞方面:应选用人源心肌细胞,如采用患者的hiPSC-CM可有望实现个性化的药物评价,并构建符合心脏组织特征的多细胞共培养模型,除血管内皮细胞之外,还应包括心肌成纤维细胞等【13】;结构方面:应尽可能模仿体内心脏组织的三维结构特征【11】,甚至扩展到不同心房心室的结构差异仿生;给药方式方面:应尽可能通过模型内的血管组织动态给药,以模拟药物在体内对心肌细胞的作用方式。接下来, 如何在同一模型中同时实现以上要点,仍将是该方向的一大挑战。但相信随着各项技术的进一步发展, 未来体外心肌组织模型的设计与构建将逐渐优化,更加合理。另一方面,人体是一个多系统和谐构成的统一整体,未来的药物心脏毒性评价模型也必将朝着多器官兼容性与整体性的方向发展,这也为科研人员接下来的研究指出了方向。
参考文献:
【1】Siramshetty V B, Nickel J, Omieczynski C, et al. WITHDRAWN-a resource for withdrawn and discontinued drugs. Nucleic Acids Res, 2016, 44(D1): D1080-1086
【2】Perlman R L. Mouse models of human disease: an evolutionary perspective. Evol Med Public Health, 2016, 2016(1): 170-176
【3】Mordwinkin N M, Burridge P W, Wu J C. A review of human pluripotent stem cell-derived cardiomyocytes for high-throughput drug discovery, cardiotoxicity screening, and publication standards. J Cardiovasc Transl Res, 2013, 6(1):22-30
【4】Jiang Y, Park P, Hong S M, et al. Maturation of cardiomyocytes derived from human pluripotent stem cells: current strategies and limitations. Mol Cells, 2018, 41(7):613-621
【5】Kim Y, Kwon C, Jeon H. Genetically engineered phage induced selective h9c2 cardiomyocytes patterning in PDMS microgrooves. Materials(Basel), 2017, 10(8):973-980
【6】Badrossamay M R, Balachandran K, Capulli A K, et al. Engineering hybrid polymer-protein super-aligned nanofibers via rotaryjetspinning. Biomaterials, 2014, 35(10): 3188-3197
【7】Huang G, Li F, Zhao X, et al. Functional and biomimetic materials for engineering of the three-dimensional cell microenvironment. Chemical Reviews, 2017:12764-12850
【8】Maiullari F, Costantini M, Milan M, et al. A multi-cellular 3D bioprinting approach for vascularized heart tissue engineering based on HUVECs and iPSC-derived cardiomyocytes. Scientific Reports, 2018, 8(1): 13532
【9】Ellis B W, Acun A, et al. Human iPSC-derived myocardium-on-chip with capillary-like flow for personalized medicine. Biomicrofluidics, 2017, 11(2): 024105
【10】Fu F, Shang L, Chen Z, et al. Bioinspired living structural color hydrogels. Science Robotics, 2018, 3(16): eaar8580
【11】Nugraha B, Buono M F, Von Boehmer L, et al. Human cardiac organoids for disease modeling. Clin Pharmacol Ther, 2019, 105(1):79-85
【12】Weng K C, Kurokawa Y K, Hajek B S, et al. Human induced pluripotent stem-cardiac-endothelial-tumor-on-a-chip to assess anticancer efficacy and cardiotoxicity. Tissue Eng Part C Methods, 2020,26(1):44-55
【13】Yang B, Lui C, Yeung E, et al. A net mold-based method of biomaterial-free three-dimensional cardiac tissue creation. Tissue Eng Part C Methods, 2019, 25(4): 243-252
作者简介:
汤亚东:广东工业大学生物医药学院副教授,硕士生导师。主要研究方向为微纳加工和微流控技术在药物缓释、干细胞与组织工程、药物评价等方面的应用。主持国家自然科学基金、广东省自然科学基金等多项国家级、省市级和校级科研项目。
苗小敏:广东工业大学生物医药学院硕士研究生,现阶段主要从事基于干细胞与器官芯片技术的体外心肌组织模型的构建及其药物毒性研究。
(作者:汤亚东、苗小敏)
(本文来源于公众号: 生物化学与生物物理进展)
 附件下载:
附件下载: