2021年3月2日,中科院生物物理所杨鹏远课题组与王凡课题组合作在《Cancer Research》杂志发表题为"Hepatitis B-induced IL-8 Promotes Hepatocellular Carcinoma Venous Metastasis and Intrahepatic Treg Accumulation"的研究论文,阐述了乙型肝炎病毒(HBV)感染中HBx诱导趋化细胞因子IL-8表达、促进肝癌血管转移和肝内调节性T细胞(Treg)浸润的分子机制,为HBV相关肝癌的防治提供了新的理论基础和干预策略。
肝癌是我国第二大致死癌症,其中HBV感染是肝癌发生的主要原因。全球超过50%的肝癌患者由HBV感染所引起,在我国约有7000万的HBV阳性人群,约80%以上的肝癌为HBV导致。临床研究表明,HBV阳性肝癌常伴随出现血管转移并在门静脉处形成癌栓(PVTT),导致患者预后较差。而 HBV感染如何诱发肝癌发生血管转移及门静脉癌栓形成的机制尚不清楚。
本文中研究人员通过对细胞因子/趋化因子array的筛选,找到了受HBV调控的炎性因子IL-8, 并在多种HBV感染模型中得到了验证。信号机制研究表明,HBV编码蛋白HBx通过MEK-ERK信号通路激活诱导IL-8的产生,IL-8通过与其受体CXCR1共同作用,导致血管内皮细胞紧密连接降低,通透性增强。
为此,研究人员构建了小鼠内皮细胞特异表达人CXCR1的转基因小鼠,在体内研究IL-8-CXCR1信号对肿瘤血管转移的影响。在肿瘤细胞中过表达IL-8激活IL-8-CXCR1信号轴的体内试验中发现, CXCR1活化可以显著特异的增强癌细胞的肝转移,但并不能再增强肺转移。进一步的机制研究表明, IL-8-CXCR1信号轴增强了肝血窦内皮细胞GARP表达,进而稳定了膜表面锚定的Latent-TGF-β,这一机制促进了肝血窦内皮细胞对Treg细胞的诱导分化,引起了癌症肝内免疫逃逸。该发现揭示了HBV相关的HBx/IL-8/CXCR1/TGF-β信号级联,诱发肝内Treg细胞聚集并增强肝癌血管转移,为HBV相关肝癌的防治提供了新的理论基础和干预策略。
该工作由中国科学院生物物理研究所、中国科学技术大学、海军军医大学东方肝胆外科医院和威尔康奈尔医学院多家单位合作完成。中国科学院生物物理研究所杨鹏远研究员和王凡研究员为本文的共同通讯作者,中国科学技术大学和中科院生物物理研究所联合培养博士生张长路、生物物理所杨鹏远组副研究员高雅楠、王凡组博士生杜成志、威尔康奈尔医学院Geoffrey J. Markowitz博士和海军军医大学东方肝胆外科医院付静博士为本文共同第一作者。该研究得到国家自然科学基金委和中国科学院的经费支持。
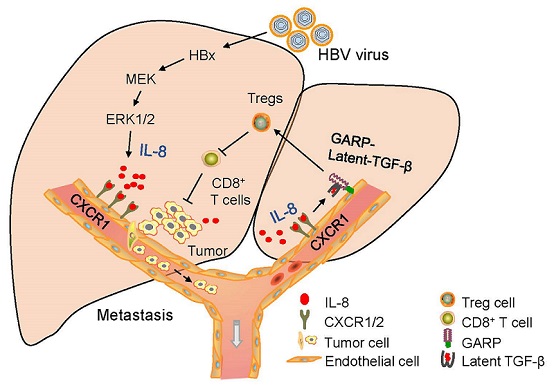
图1. HBx-IL-8-CXCR1信号轴促进HBV阳性肝癌血管转移和免疫逃逸模式图.
文章链接:https://cancerres.aacrjournals.org/content/early/2021/03/02/0008-5472.CAN-20-3453
(供稿:杨鹏远研究组)
