近年来,肿瘤免疫治疗发展迅速,许多肿瘤患者更是因此而获益。2018 年诺贝尔生理学或医学奖便颁发给了在肿瘤免疫领域做出杰出贡献的美国免疫学家詹姆斯·艾利森(James P Alison)和日本免疫学家本庶佑(Tasuku Honjo)。但是临床数据显示,免疫疗法对相当一部分肿瘤患者治疗效率很低,且表现出较强的副作用,令免疫系统攻击人体的一些正常组织、器官,有时甚至危及生命。随着越来越多肿瘤免疫治疗药物的出现,以及免疫组合疗法的开展,提高免疫检查点抑制剂的药效并减少其副作用的需求也日益迫切。
为了解决这一问题,中国科学院生物物理所王峰研究员领导的团队,与北京大学深圳研究生院曹宇以及美国斯克里普斯研究所Peter Schultz课题组合作,首次提出将肿瘤靶向识别与免疫检查点抑制相结合,使免疫检查点抑制剂可以有效的靶向至黑色素瘤的肿瘤微环境内并发挥免疫调节作用。近日,相关研究成果发表在《美国国家科学院院刊》(Proceedings of the National Academy of Sciences,PNAS)上。
在这一研究中,作者将促黑素细胞激素类似物 NDP-MSH通过化学连接的方法,与PD-L1抗体产生共价链接,形成双特异型抗体NDP-MSH-αPD-L1。通过实验分析说明,双特异型抗体NDP-MSH-αPD-L1对于黑色素瘤细胞表面的MC1R受体和PD-L1都有很强的结合活性。在小鼠黑色素瘤模型中,肿瘤靶向的免疫检查点抑制剂双特异型抗体NDP-MSH-αPD-L1在同样剂量下展现出比PD-L1抗体更加显著的肿瘤生长抑制活性。一系列的实验证明,NDP-MSH-αPD-L1的肿瘤生长抑制活性与肿瘤内部的浸润性淋巴细胞的数量呈正相关性,揭示了NDP-MSH-αPD-L1的抑制肿瘤生长的机制:通过在肿瘤微环境中抑制其免疫逃逸机制,增加浸润性淋巴T细胞的数量,增强免疫响应,从而达到抑制肿瘤生长的目的。
NDP-MSH-αPD-L1展现出的显著的效果,为未来将肿瘤靶向的免疫检查点抑制剂应用于其它不同种类的实体肿瘤建立了基础。王峰博士的研究团队也在致力于不断发现以及优化靶向不同肿瘤的双特异型抗体架构,希望可以进一步提高肿瘤靶向的免疫检查点抑制剂的疗效和安全性。
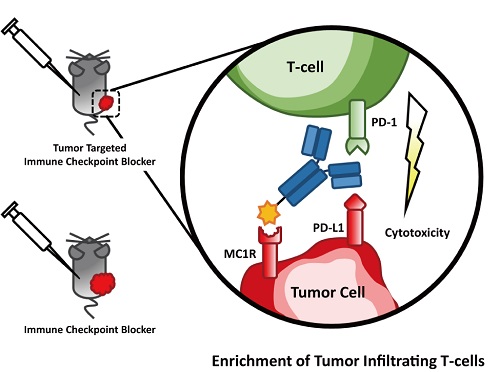
肿瘤靶向的免疫检查点抑制剂NDP-MSH-αPD-L1抑制肿瘤生长示意图
文章链接:https://www.pnas.org/content/early/2019/07/11/1905646116
(王峰研究组供稿)
