2018年4月3日,《ACS Nano》杂志在线发表了中国科学院生物物理研究所阎锡蕴课题组与中国科学院自动化研究所田捷课题组合作完成的铁蛋白穿越血脑屏障并靶向治疗恶性脑瘤的最新研究成果。这项研究首次发现铁蛋白可以穿越血脑屏障,并可作为药物载体,实现对原位恶性脑胶质瘤的靶向和有效治疗。这是阎锡蕴课题组继发现铁蛋白的肿瘤靶向性,并将其应用于肿瘤的体外诊断(Nature Nanotechnology,2012)、体内治疗(PNAS,2014)及体内肿瘤多模成像(ACS Nano, 2016)之后的又一项重要成果。
血脑屏障是维持中枢神经系统稳态和保护脑部组织免受代谢产物损伤的天然屏障。然而,在保护神经系统的同时,血脑屏障也使得几乎100%的大分子药物和98%的小分子药物无法有效到达脑组织,导致大部分中枢神经系统疾病,如恶性脑瘤得不到有效的治疗。因此,对于恶性脑瘤等脑内疾病来说,目前临床治疗面临的最大挑战就是如何有效地使探针或者药物穿过血脑屏障。
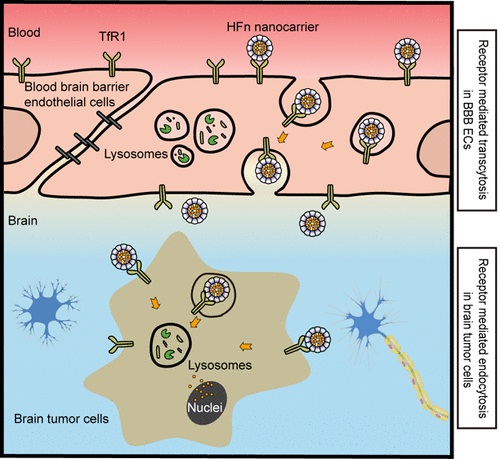
受体介导的转胞吞作用是目前最有效的一种介导生物大分子药物穿越血脑屏障的途径。其中,转铁蛋白受体1(TfR1)是最具代表性的一种转胞吞作用受体。由于TfR1在脑内皮细胞和恶性脑瘤细胞上同时高表达,理论上靶向TfR1的药物既可以穿越血脑屏障,又可以富集至脑内恶性脑瘤部位。然而,由于目前大部分靶向TfR1的抗体或者配体与TfR1的亲和力过高,在穿越血脑屏障的过程中会被富集到脑内皮细胞的溶酶体中降解,导致其无法穿越血脑屏障到达病灶。
在寻找理想的TfR1配体的研究中,研究人员首次发现,铁蛋白与受体TfR1结合后,会通过脑内皮细胞的转胞吞作用穿过血脑屏障,而不会被阻断在溶酶体之中;而在恶性脑瘤细胞中,在受体TfR1的介导下,铁蛋白会被特异性地富集到溶酶体中降解,进而释放其内部装载的药物。铁蛋白的这种特性,使得其成为理想的能穿越血脑屏障并用于恶性脑瘤治疗的药物载体。在正常小鼠中,研究人员证实铁蛋白可有效穿越完整的血脑屏障;在恶性脑瘤原位移植瘤小鼠模型中,铁蛋白在穿越血脑屏障后,可以特异性地富集到肿瘤区域并抑制恶性脑瘤的生长,而在正常的脑组织无明显的富集。另外,动物安全性实验及病理学分析表明,铁蛋白可特异性地杀伤恶性脑瘤,而对正常脑组织无损伤。研究表明,铁蛋白与TfR1合适的结合亲和力、多结合位点的对称性结构以及理想的纳米尺寸效应是其既可以穿越血脑屏障又对肿瘤组织具有优异的选择性的原因。
结合本研究最新发现的铁蛋白的特性,及其易于制备、生物相容性好,药物装载量高等特点,铁蛋白可以作为一种理想的用于恶性脑瘤靶向治疗的纳米药物载体。同时,铁蛋白也为其他类型的中枢神经系统疾病,如神经退行性疾病提供了一个潜在的纳米药物载体平台。
阎锡蕴课题组范克龙副研究员、博士生周萌,田捷课题组贾晓花博士为该论文的共同第一作者。该研究得到了国家自然科学基金重点项目、科学院先导项目、国家科技重大专项、青年人才托举工程等项目的资助。
文章链接:https://pubs.acs.org/doi/10.1021/acsnano.7b06969
供稿人:阎锡蕴组范克龙
