基于单分子定位的超分辨显微成像技术PALM打破了光学衍射极限,于2014年获得了诺贝尔化学奖。相对于目前广泛使用的其它超分辨成像技术而言,该技术具有最高的空间分辨率(~20 nm),因此在生物学中带来了广泛的应用。但是由于该技术需要成千上万张原始图片来重构一张超分辨图像,时间分辨率低,在活细胞中应用该技术面临挑战。
另外,受现有光控荧光蛋白的限制,观察发育过程中超早期结构成像也是目前超高分辨率成像面临的另一挑战。用荧光蛋白标记发育生物具有非入侵,低毒害,低背景等特点,但由于荧光蛋白的折叠和成熟以及累积需要时间,其荧光信号的出现往往滞后于发育中某些早期事件的发生。更早发光的荧光蛋白往往能捕捉发育中更早出现的结构或事件,也使得依据荧光信号进行的定量分析和数据解释变得更加精确和可靠。但目前,在超分辨成像中应用较广的光转化荧光蛋白均不具有发光早的特性。
针对超分辨成像中的这两个问题,徐涛院士研究组和徐平勇课题组合作,开发了一个新型光转化荧光蛋白探针pcStar和一种新型活细胞超分辨成像方法Quick-SIMBA。与合作团队前期发表的被广泛使用的mEos3.2 (Nature Methods,2012) 相比较,pcStar荧光蛋白探针具有发光早,光转化效率高等特点,有利于提高单分子超分辨成像技术的时间分辨率和标记密度,同时可以应用于对短寿命生物分子/结构的超分辨成像。应用新一代单分子定位超分辨成像探针pcStar,课题组成员在细菌,真核细胞系,胎鼠神经干细胞以及果蝇胚胎中均实现了超早期标记。Quick-SIMBA是在徐平勇课题组前期发展的单分子定位超分辨技术SIMBA (Cell Research,2017) 的基础上,结合pcStar探针、sCMOS相机和改进算法提出的新一代活细胞超分辨成像方法。该技术在目前活细胞单分子定位成像技术中具有最高的时空分辨率(0.1-0.25 s, 50 nm),能够很好解析活细胞中的密集管状内质网(图1),这一结构曾因传统成像的时空分辨率不足,而被长时期认为是连续的片状结构。另外,结合pcStar和SIMBA成像技术,课题组成员对果蝇胚胎发育中的超早期结构进行了标记和超分辨成像解析,为该结构的发育形成过程提供了新的证据和视角。
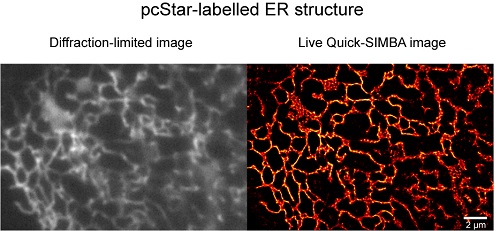
图1:Quick-SIMBA 解析的内质网 (pcStar 标记) 超分辨结构
这一研究成果于10月2日在Nano letters上在线发表,并入选该杂志2020年第四期封面论文,题为 “Fast super-resolution imaging technique and immediate early nanostructure capturing by a photo-convertible fluorescent protein”。该研究工作由中科院生物物理所、中科院计算所、中科院遗传发育所等机构合作完成。生物物理所副研究员张名姝,博士研究生付志飞和副研究员李常青为本文的共同第一作者,徐涛院士和徐平勇研究员为本文的共同通讯作者。徐涛院士领衔的仪器研发团队近年来致力于显微成像仪器设备和技术方法的研究和开发,先后研制出偏振单分子干涉成像、冷冻单分子定位成像以及超分辨光电融合成像系统,开发了多种新的超分辨显微成像方法。徐平勇课题组主要致力于发展多种用于超分辨成像如PALM/STORM、SOFI、SIM等的探针,并基于探针的光化学特性发展新的成像方法如贝叶斯单分子超分辨成像方法SIMBA等,来提高超分辨成像的时空分辨率。该工作是徐涛院士和徐平勇课题组合作产生的又一个成像探针和方法相结合的超分辨成像研究成果。
该研究得到了科技部重点研发计划、国家自然科学基金和中科院先导专项等项目的大力支持。
文章链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.9b02855
(供稿:徐平勇研究组)
