
王江云研究组与合作者在利用自由电子激光技术
捕捉C-H键活化的激发态中间体研究方面获得重要进展
2022年7月18日,Nature Chemistry (IF:24.27)期刊发表了王江云研究组、日本冈山大学沈建仁研究组和中国科学院植物研究所于龙江研究组合作完成的题为"Excited state intermediates in a designer protein encoding a phototrigger caught by XFEL"的研究文章。该项工作报道了人工设计的含氧杂蒽酮基团氨基酸的人肝脂肪结合蛋白(FABP)突变体可以进行高效特异性的光驱动C-H键活化;利用自由电子激光设施解析了突变体在无光照条件和闪光光照10-300纳秒后的高分辨率晶体结构(1.55-1.70 Å),捕捉到了C-H键活化的激发态中间体结构。
解析短寿命的化学反应中间体的结构始终是一个巨大的挑战。利用自由电子激光设施解析时间分辨飞秒X-射线晶体结构使得研究蛋白质的反应动力学结构成为了可能。光系统II中的O=O键形成中间体,光激活黄色荧光蛋白和视紫红质中的C=C键异构中间体,CO-肌红蛋白中的Fe-C断裂中间体等都用自由电子激光设施进行过反应中间体的探测研究。但是,这种技术现在还仅限于少数几种天然的光激活蛋白质。利用自由电子激光设施研究反应中间体最大的困难在于缺乏合适的光激发基团启动fs-ms尺度的化学反应,许多重要的酶催化化学反应,包括有机合成和蛋白质化学中至关重要的C-H键活化反应等,受到样品的限制难以对其反应过程中关键中间体进行原子分辨率的观察,极大限制了对此类反应酶的智能设计。
王江云研究组基于基因密码子扩展技术实现了多种具有特殊物理化学性质的非天然氨基酸在蛋白质中的编码。光激发后非天然氨基酸氧杂蒽酮丙氨酸(FXO)可以以接近100%的效率转换成长寿命的三线态FXO*,这种三线态具有很强的氧化还原能力。研究将FXO遗传编码插入到理性设计的FABP突变体FABP1-63FXO69A71M(XOM)。一系列谱学及结构学实验证明FXO和附近的Met71发生了C-H键活化和C-C键生成反应。利用SPring-8 Ångstrom Compact Laser (SACLA)自由电子激光设施,按照光泵-探测方案收集了时间分辨飞秒晶体学衍射数据,首次捕捉到了C-H键活化反应中隐藏的关键反应中间体。第一次提供了C-H键活化反应过程中三线态酮参与的中间体的结构。研究结果表明可以在人工设计蛋白中通过理性设计使得FXO激发态的反应均一地向C-H键活化或电子传递方向发生,这种人工设计的反应靶向性对于其在自由电子激光技术的应用以及酶的设计至关重要。
尽管自由电子激光技术产生的时间分辨蛋白质晶体结构可以在时间和空间尺度无与伦比的描绘蛋白质功能执行中的构象变化,但现在的研究大都局限于一些天然的光活性蛋白质。而且由于这种技术需要数以克计的蛋白质微晶也使得大多数蛋白质遥不可及。该研究利用蛋白质设计和高效的FXO遗传编码技术,使得一些易于表达和结晶的小分子量蛋白可以行使多样的光激活化学反应,从而大大拓展了自由电子激光技术研究反应中间体的受众范围。由于三线态酮与许多金属酶中的高价金属-氧的结构在功能上相当,因此该研究发现有助于新的酶和材料的设计。这种在蛋白质内部引入定点交联从而提高蛋白质热稳定性的方法对治疗性抗体和工业酶的设计改造也将具有重大意义。
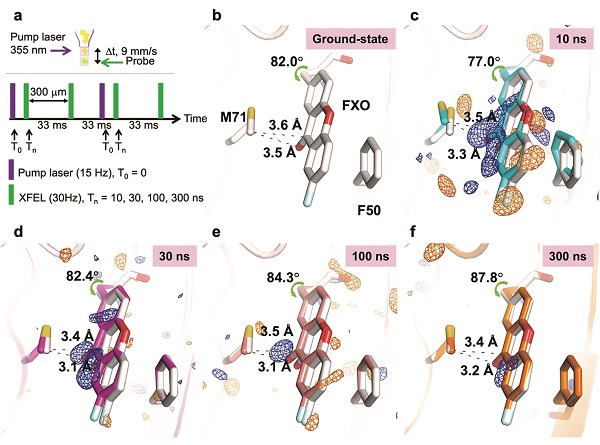
图:XOM突变体C-H键活化的结构快照
中国科学院生物物理研究所王江云研究员、日本冈山大学沈建仁教授和中国科学院植物研究所于龙江研究员为本文的共同通讯作者,中国科学院生物物理研究所刘晓红研究员、刘鹏程博士,日本冈山大学李洪杰博士及中国科学院生物物理研究所许震博士为本文共同第一作者。生物物理所博士生许震、贾璐、夏颜、俞敏玲、唐文勤、祝晓蕾和博士后陈超、张远林参与了研究工作。该研究得到科技部、国家自然科学基金委和中国科学院的经费支持。
文章链接:https://www.nature.com/articles/s41557-022-00992-3
(供稿:王江云研究组)
附件下载: